UNIVERSTA’ DEGLI STUDI DI BARI
FACOLTA’ DI MEDICINA E CHIRURGIA
SCUOLA DI SPECIALIZZAZIONE IN GINECOLOGIA E OSTETRICIA
DIRETTORE: PROF. ETTORE CICINELLI
TESI DI SPECIALIZZAZIONE
LA MISURA DEL pH DEL SANGUE SU ARTERIA OMBELICALE ALLA NASCITA:
TENTATIVO DI STANDARDIZZAZIONE DELLO STATO NEONATALE
RELATORE:
CHIAR.MO PROF. SERGIO SCHÖNAUER
SPECIALIZZANDA
DOTT.SSA ISABELLA de BELLIS
ANNO ACCADEMICO 2002-03
INDICE
Introduzione generale
a lungo termine
6. Il valore della misura routinaria del pH
del cordone ombelicale alla nascita
7. Valutazione del benessere neonatale con determinazione
Routinaria del pH sul cordone ombelicale dopo il parto a
Bolzano: 2 casistiche a confronto
8. Riflessioni sugli aspetti Medico-Legali
CAPITOLO 1
EQUILIBRIO ACIDO-BASE
1.1 Equilibrio acido-base nell’adulto
Il pH è una misura della reazione acido-basica di una soluzione e rappresenta il logaritmo dell’inverso della concentrazione degli ioni idrogeno:
PH= ____1_____ = − log. Conc H+
Conc H+
Per tanto la regolazione dell’equilibrio acido-base esprime la regolazione di ioni idrogeno nei liquidi dell’organismo(1). La loro concentrazione è un fattore fondamentale per il mantenimento dell’omeostasi dell’organismo.
Nell’adulto il pH normale del sangue arterioso è di 7.4, valori superiori o inferiori al range di normalità sono espressione rispettivamente di alcalosi e acidosi.
Il metabolismo dell’adulto, così come quello del feto, è di tipo aerobio, caratterizzato in presenza di ossigeno, dalla completa ossidazione dei carboidrati con liberazione di energia. I prodotti finali del metabolismo ossidativo sono l’anidride carbonica (CO2) e l’acqua (H2O).
La CO2 è un gas altamente diffusibile e la sua concentrazione è inversamente correlata con il pH. Quando la CO2 gassosa è in equilibrio con la CO2 disciolta nel plasma, le pressioni parziali di entrambi sono uguali .
La presenza dell’enzima anidrasi carbonica, all’interno dei globuli rossi, permette la rapida idratazione della CO2 con conseguente formazione di acido carbonico (H2CO3) che a sua volta va in contro a dissociazione con formazione di ioni idrogeno(H+) e ioni bicarbonato (HCO3-): sono, queste, reazioni in costante equilibrio espresse con la equazione della carbonico-anidrasi :
CO2 + H2O « H2CO3 « H+ + HCO3- (1)
Il pH del plasma dipende dal rapporto tra le concentrazioni plasmatiche dei bicarbonati e della CO2 ed è espresso mediante la equazione di Handerson-Hasselbach :
pH = 6.1 + log ([ HCO3- ] / [ s x pCO2 ] ) (2)
dove il pH è quello plasmatico , HCO3 è la concentrazione degli ioni bicarbonato nel plasma, (s x pCO2) è la concentrazione della CO2 disciolta nel plasma, che è espressione sia della pressione parziale di CO2 (pCO2), sia del coefficiente di solubilità della CO2 nel plasma stesso.
L’equazione di Handerson-Hasselbach consente di riassumere lo stato di equilibrio metabolico acido-base plasmatico mediante un solo valore, il pH, in modo che la sua valutazione sia applicabile alla pratica clinica.
Il mantenimento di un pH fisiologico nei liquidi dell’organismo è di fondamentale importanza per il mantenimento dell’omeostasi dell’organismo.
Una severa acidosi può causare il coma e la morte, così come una severa alcalosi può essere letale causando convulsioni e coma.
Dato che la concentrazione degli H+ gioca un ruolo così importante nell’omeostasi, il corpo reagisce fisiologicamente contro queste variazioni mediante la regolazione respiratoria, la regolazione renale e i sistemi tampone dei liquidi organici (1).
Regolazione respiratoria.
Un aumento della concentrazione di CO2 nei liquidi corporei abbassa il pH verso l’acidità, mentre una sua diminuzione sposta il pH verso l’alcalinità.
È sulla base di questo effetto che il sistema respiratorio è in grado di far variare il pH in un senso o nell’altro per un’azione diretta degli ioni idrogeno sul centro respiratorio bulbare quindi sulla ventilazione polmonare.
Infatti una diminuzione del pH al di sotto di 7.4 può far aumentare la ventilazione polmonare fino a 4-5 volte il valore normale, mentre l’alcalosi può ridurre la ventilazione polmonare fino al 50-75 % del normale.
Il potere tampone complessivo del sistema respiratorio è una o due volte superiore a quello di tutti i tamponi chimici dell’organismo e impiega, rispetto a questi, da 1 a 3 minuti per poter riportare alla normalità una brusca variazione di concentrazione idrogenionica (1).
Regolazione renale.
La regolazione renale dell’equilibrio acido-base, tra i sistemi di regolazione, è il più potente, ma richiede un tempo molto più lungo, da diverse ore ad alcuni giorni per riequilibrare la concentrazione idrogenionica.
Il rene regola la concentrazione idrogenionica principalmente facendo variare, in più o in meno, la concentrazione di ioni bicarbonato nei liquidi corporei, attraverso una complessa serie di reazioni che si attuano a livello dei tubuli renali, e che comprendono la secrezione di ioni idrogeno, il riassorbimento di ioni sodio, l’escrezione di ioni bicarbonato nell’urina e la secrezione di ammoniaca nel lume tubulare (1).
Isistemi tampone.
I sistemi tampone acido-base possono immediatamente combinarsi con qualsiasi radicale acido o basico e impedire così, cospicue variazioni della concentrazione idrogenionica entro una frazione di secondo.
I tamponi sono divisi in tamponi bicarbonato e in tamponi non bicarbonato, i quali sono responsabili per il 53% e il 47% della capacità tamponante totale rispettivamente (1).
I tamponi bicarbonato, presenti principalmente nei globuli rossi, che contengono anidrasi carbonica, tamponano gli H+ secondo la equazione seguente:
H+ + HCO3 - « H2CO3 « CO2 + H2O (3)
I tamponi non bicarbonato comprendono l’emoglobina, i fosfati organici e inorganici e le proteine plasmatiche. Tra, questi, l’emoglobina è responsabile della maggior parte dell’azione tamponante secondo la seguente equazione:
H+ + HbO2 « HHb + O2 (4)
Acidosi respiratoria e metabolica
· L’acidosi respiratoria si manifesta spesso in varie condizioni patologiche, come ad esempio, in tutti quei casi di forte riduzione della superficie respiratoria polmonare ed in qualsiasi altra condizione che interferisca con gli scambi gassosi tra sangue ed aria alveolare. Si formano, così, eccessivi livelli di anidride carbonica (CO2) che viene convertita in acido carbonico (H2CO3) e in fine in H+ e CO3- (secondo la equazione 1)
· L’acidosi metabolica può essere dovuta ad eccessiva formazione di acidi metabolici nell'organismo, come avviene nel diabete mellito, a perdita di alcali, come avviene nella diarrea grave e nel vomito, alla insufficienza funzionale dei reni che non riescono ad eliminare le normali quantità di acidi, che quotidianamente vengono prodotti dai processi metabolici ed infine alla somministrazione orale o parenterale di metaboliti acidi (1).
La componente respiratoria dell’acidosi è misurata dalla pCO2 attuale.
In condizioni normali la pCO2 arteriosa è di 40mmHg, valori superiori sono riscontrati nell’acidosi, valori inferiori nell’alcalosi.
La componente metabolica può essere misurata con il buffer base (BB), con il base excess (BE), con i bicarbonati standard o con il pHqu40, tutte grandezze che variano in modo proporzionale (1).
Nella pratica clinica è preferibile adoperare il base excess, che rappresenta la differenza tra il potere tampone attuale di un determinato campione di sangue e il suo potere tampone teorico normale.
Il BE si calcola con la seguente formula:
BE= BB attuale – BB normale
ed è misurato in millimoli per litro.
In condizioni fisiologiche di perfetto equilibrio il BE sarà pari a 0 poiché in tal caso il BB attuale è uguale al BB normale.
Rispetto al BB, il BE ha il vantaggio di essere indipendente dalla concentrazione emoglobinica e di esprimere la condizione con evidenza immediata: infatti è negativo in caso di acidosi metabolica e positivo in caso di alcalosi metabolica (1).

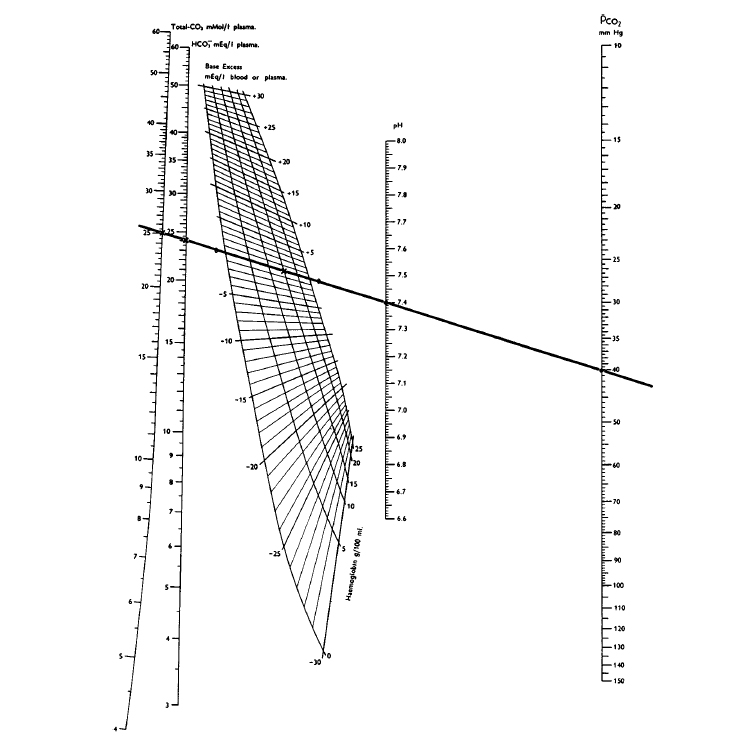
Figura.
Nomogramma lineare di Siggard-Andersen per il calcolo dell’ eccesso base sulla base di pCO2 e pH
Con questo nomogramma , se due fattori della equazione di Henderson-Hasselbach (eq. 2) sono noti, possono essere utilizzati per determinare il terzo fattore.
L’eccesso di basi può essere calcolato a partire dal punto in cui la linea taglia l’area curva del nomogramma. L’eccesso di basi nel sangue è definito come la base titolabile del sangue e può essere sperimentalmente determinata dalla titolazione con acidi forti o basi ad un pH plasmatico di 7.40 con pCO2 = 40 mmHG a 37 °C . Alternativamente gli analizzatori acido base automatici usano le seguenti formule :
Concentrazioni di bicarbonati:
log10 [ HCO3- ] = pH + log10 pCO2 – 7.604 (5)
Base excess del sangue :
(1- 0.014[ Hb] )([ HCO3- ] − 24 + [ 1.43(Hb) + 7.7 ] [ pH – 7.4 ] ) (6)
L'eccesso di basi del liquido extracellulare o l’eccesso base standard è una misura della componente metabolica dell’equilibrio acido base in un paziente.
Come la base titolabile del sangue, l'eccesso base del liquido extracellulare può essere sperimentalmente determinato dalla titolazione di un modello di liquido extracellulare (1).
Gli analizzatori acido-base calcolano l’eccesso di basi del liquido extracellulare nel modo seguante :
base excess nei fluidi extracellulari :
(HCO3-) –25 + 16.2 (pH – 7.40 ) (7)
Dalle formule per l’eccesso di basi ematico e del liquido extacellulare appare evidente che i valori saranno simili sebbene statisticamente differenti.
Considerando un esempio ipotetico, assumendo che HCO3- = 15, HB=18,
pH= 7.2, l’eccesso basi calcolato sarà –12.56 mmol/l nel sangue e –13.24mmol/l nel liquido extracellulare. L’eccesso di basi del liquido extracellulare rappresenta meglio la capacità dell’organismo di prevenire una caduta del pH.
La componente respiratoria e quella metabolica possono variare indipendentemente l’una dall’altra, anzi l’organismo compensa per mezzo dell’una le alterazioni dell’altra. Tipico esempio è l’iperventilazione che si instaura in caso di acidosi metabolica e che, riducendo la pCO2 , entro certi limiti riesce ad evitare sensibili variazioni di pH (1).
1.2 Equilibrio acido-base nel feto
Nel feto, i meccanismi di compenso dell’equilibrio acido base, presenti nella vita post-natale, non sono ancora attuabili, poichè i polmoni e i reni del feto sono in fase di maturazione e piuttosto, da questo punto di vista, privi di funzione,. Pertanto, lo scambio gassoso fetale e l’equilibrio acido-base sono garantiti dalla placenta mediante un processo simile a quello dell’emodialisi.
In condizione di normalità, il sangue fetale ha una pO2 inferiore a quella del sangue materno, una pCO2 superiore, un pH più basso e un BE negativo più pronunciato. Questa condizione determina il presupposto fisico-chimico perché possano avvenire gli scambi transplacentari nel senso fisologico.
Nel 1989 l’American College of Obstetrics and Gynecologists (ACOG) rilasciava un bollettino tecnico contenente la seguente breve review sulla regolazione acido-base fetale e neonatale (2):
"Durante il metabolismo, l’organismo produce acido carbonico e altri acidi organici. L’acido carbonico (H2CO3) è formato dalla idratazione del biossido di carbonio (CO2) durante il metabolismo ossidativo…Il biossido di carbonio diffonde attraverso la placenta molto rapidamente. La quota di questa eliminazione è direttamente correlata alla quota di flusso ematico su entrambi i lati della placenta. Diversi acidi organici, inclusi l’acido lattico e l’acido idrossibutirrico, sono prodotti dalla glicolisi anaerobica. Il feto si libera di questi acidi, i quali diffondono molto più lentamente della CO2 attraverso la placenta. Per questo motivo l’acidosi metabolica impiega più tempo per la correzione rispetto all’acidosi respiratoria.
Il feto è soggetto sia all’acidosi respiratoria che metabolica. Ad esempio le condizioni che interrompono il normale flusso ematico tra il feto e la placenta (ad.es. l’occlusione del cordone ombelicale) potrebbero causare un rapido incremento della CO2 e conseguente acidosi respiratoria. Se la perfusione ematica fetale viene ridotta più a lungo, il feto svilupperà ipossia, acidosi metabolica e asfissia.
Un sistema di tamponi, nel sangue e in altri tessuti, permette all’organismo di mantenere il pH a livelli relativamente costanti, nonostante la continua produzione di acidi dal metalobismo cellulare.
I bicarbonati plasmatici e l’emoglobina sono i due più importani sistemi tampone ed ammontano, approssimativamente, al 70% del totale di tutti i sistemi tampone nel sangue. Altri sistemi tampone includono i bicarbonati eritrocitari (18%) le proteine plasmatiche (7%) e i fosfati inorganici (5%)."
Fra le numerose possibili cause che possono disturbare lo scambio transplacentare e determinare acidemia fetale, vi sono le patologie materne respiratorie e cardiache, la compressione dell’aorta materna, il distacco parziale della placenta, infarti placentari acuti, una diminuzione critica della perfusione utero-placentare durante il travaglio e la compressione del cordone ombelicale o dei grossi vasi corionici.
Questi scambi placentari insufficienti possono insorgere in modo acuto e risolversi prontamente o ripetersi nel tempo e croniccizzarsi, ma il risultato finale è sempre una acidosi respiratoria fetale primaria determinata da ritenzione di CO2 (3).
L’aumento della pCO2 porta per idrolisi alla dissociazione dell’acido carbonico (H2CO3) e ad una caduta del pH.
Per valori di pO2 <12 mmHg (Saling) nel feto si attiva la glicolisi anaerobica ed aumenta la produzione di lattato.
L’orientamento del catabolismo glucidico verso la via anaerobica provoca quindi un’ accumulo di acido lattico. Da cui dipende l’acidosi metabolica.
Nell’ ipossia acuta del feto normale, la componente respiratoria precede di poco la componente metabolica, alla quale si associa abbastanza rapidamente. Ma la via anaerobica, a cui il sistema enzimatico fetale è adattato, è meno efficace:
una molecola di glucosio, in presenza di ossigeno, produce 38 molecole di adenosina trifosfato (ATP) e 6 molecole di CO2. In assenza di ossigeno produce 2 molecole di ATP e 2 molecole di acido lattico.
Per fornire la stessa energia il feto ha bisogno di molto glucosio, e quindi, di accelerare la glicolisi per sopperire al fabbisogno energetico delle funzioni vitali fondamentali, con conseguente formazione di acido lattico in prevalenza, di acido piruvico e di acido idrossibutirrico, che non possono essere degradati ad H2O e CO2 attraverso il ciclo di Krebs, poichè per la mancanza di ossigeno, gli enzimi respiratori nei mitocondri non convertono più l’idrogeno in H2O, così tutto il NAD nel citoplasma si trasforma in NADH aumentando, quindi, la quota di acidi fissi non volatili ( rivedi concetto su un testo di biochimica).
I sistemi tampone più efficaci per contrastare l’acidosi sono rappresentati dai bicarbonati plasmatici e dall’ emoglobina.
L’acido lattico viene tamponato nel feto dal bicarbonato di sodio portando ad un aumento della CO2 ed ad una diminuzione delle basi tampone (4).
L’acidosi riduce notevolmente l’affinità dell’emoglobina all’ossigeno (effetto Bohr), favorendone la liberazione. L’emoglobina liberata funge così da tampone acido-base, capta gli ioni idrogeno e frena la caduta del pH.
Ma questo efficace processo per contrastare l’acidosi non dura a lungo, poiché quando il sistema tampone è saturo, il pH cala abbastanza rapidamente. Questo spostamento dei tamponi conduce ad un lieve aumento della pCO2 ed ad una diminuzione di bicarbonato. Aggiungendo una componente metabolica all’acidosi (5).
Rooth et al. hanno calcolato a partire da osservazioni cliniche, la rapidità del calo del pH a seconda delle interruzioni degli scambi (6). Quando l’apporto di ossigeno viene totalmente interrotto, il pH scende di 0,5 unità in 3-4 minuti; quando il deficit è del 10% passano 30 minuti prima di riscontrare lo stesso calo di 0,5 unità; quando è del 4%, passano 60-80 minuti.
Indubbiamente esiste anche un’acidosi di origine materna per aumento del lattato e diminuzione delle riserve tampone, l’acidosi fetale che ne consegue non necessariamente è espressione di sofferenza fetale. Quest’ultima condizione viene denominata acidosi fetale "da infusione" o "di origine materna" per differenziarla da quella asfittica che origina primitivamente nel compartimento fetale.
Ad. es. nel corso del travaglio di parto normale si assiste ad un modesto aumento dell’acidosi fetale, soprattutto a carico della componente metabolica. Nel sangue materno si verifica similmente, con frequenza, un’aumento dell’acidosi metabolica a causa dell’aumentata concentrazione plasmatica di lattati come risultato delle contrazioni uterine e muscolari, invece la pCO2 materna è spesso notevolmente diminuita già dall’inizio del travaglio come conseguenza dell’iperventilazione che la donna mette in atto in modo quasi inconscio (7). Più temibile è, invece, l’acidosi fetale secondaria a diabete materno con chetoacidosi: gli acidi non volatili provenienti dal letto ematico materno, tendono ad essere trattenuti nel contesto della placenta tramite un flusso unidirezionale e ad accumularsi nel sangue fetale.
Goeschen et al. hanno dimostrato che l’acidemia materna durante il parto potrebbe contribuire ad abbassare il pH fino a 7.10 e solo in meno dell’ 1% dei casi al di sotto di 7.10. Nessuno dei casi con pH fetale più basso di 7.0 è attribuibile all’acidemia materna (8). Uno studio di Roemer descrive il miglioramento del pH neonatale con una modificazione delle tecniche respiratorie materne (9).
1.3 Può il pH del sangue fetale essere considerato il Gold Standard per la definizione biochimica di asfissia fetale?
Ai fini pratici per la definizione su base biochimica degli stati di sofferenza fetale, si utilizza la valutazione, su sangue fetale, di parametri principali dell’equilibrio acido-base : pH, pressione parziale di CO2 (pCO2), lattati, eccesso basi (BE).
Molti studiosi di medicina perinatale e fetale affermano che le misure delle componenti metaboliche dell’acidemia fetale, per es. eccesso basi, sono predittori migliori della compromissione fetale e dell’outcome neonatale rispetto al solo pH del sangue fetale (10,11).
Vandebusshe ritiene, invece, che il pH rappresenti per il futuro il gold standard per una definizione biochimica di asfissia fetale (12).
Nei prossimi paragrafi si discute il significato e l’utilità dei principali parametri biochimici dell’acidemia fetale quali BE e lattati in relazione alla semplice misura del pH in medicina fetale.
1.3.1 Eccesso basi (BE) nella medicina fetale e perinatale
Già nel 1916 Arvo Ylppo descrisse come agitava campioni di sangue neonatale nell’aria ambiente al fine di togliere l’eccesso di CO2 (13) e agli inizi degli anni 60 Erich Saling descrisse come considerava il pH dove aveva equilibrato il campione di sangue fetale con CO2 ad una pressione di 40mmHg (10).
Saling chiamò questo valore di pH: il pHqu40 ed introdusse questo componente metabolico dell’acidosi.
Purtroppo l’uso sensato della pCO2 o delle denominazioni da essa derivate, come misure rilevanti dell’outcome neonatale o addirittura come fattore prognostico, è attualmente limitato da qualche problema fondamentale, soprattutto concernente l’acquisizione dei valori di eccesso basi e la loro interpretazione fisiopatologica.
Misure attuali di pH sono più precise della pCO2 ,come dimostra un lavoro di Vandebbushe in cui ha ricercato la riproducibilità delle misure di pH su sangue dell’arteria ombelicale (12) riscontrando che la deviazione standard (SD) delle differenze tra due misure di pH, prese circa 5 minuti dopo il parto, era di 0.03 unita di pH.
Nello stesso studio la SD di differenze di pCO2 era 0.88 Kpa.
Un coefficiente di variazione più alto per la pCO2 piuttosto che del pH, poteva essere anticipato. Perché il metodo originario di determinazione della pCO2, come descritto da Severinghouse, comprendeva 3 misure di pH : due come misure fisse (una alta e una bassa) calibrate con pCO2 , per definire la linea tampone, ed una misura di pH alla pCO2 attuale per definire il punto attuale di pH/pCO2 della linea tampone (14).
Generalmente l’eccesso basi non viene misurato dall’analizzatore del pH, ma calcolato sulla base di valori di pH più precisi e di valori di pCO2 meno precisi (vedi nomogramma di Siggard-Andersen)
Le differenti formule utilizzate per questi calcoli nell’ analizzatore, non sono mai del tutto corrette e, certamente, tanto meno nella situazione fetale.
Queste formule presuppongono la presenza dell’emoglobina adulta ,con la tipica curva di saturazione dell’ossigeno e la capacità di potere tampone dell’adulto, così come il rapporto normale esistente nell’adulto tra il compartimento dei fluidi extracellulari e il plasma.
Bisogna considerare che sono spesso assunti valori standard di temperature di concentrazione di emoglobina. Inoltre queste formule sono state testate in situazioni in vitro, mentre l’eccesso basi del feto, in vivo, può differire significativamente da quello calcolato.
Gli autori, infine, raramente descrivono quale particolare algoritmo viene utilizzato o raramente indicano se hanno utilizzato una formula per il BE del sangue intero o per il BE del fluido extracellulare (BEECF ).
Nell’acidemia fetale severa il BE del sangue intero può facilmente eccedere il BEEC del 50% o adirittura del 100%, pertanto, è necessario considerare problemi di riproducibilità tra i diversi Centri.
Per completare il tutto c’è anche il problema dei differenti punti cut-off tra valori normali e anormali (15,16,17).
Il valore di cut-off più comunemente utilizzato per le basi tampone (BB) è di 34mmol/l (18), per il BE del sangue intero è di 12mmol/l (19,20), e per il BEECF è di 10mmol/l (21).
Il nomogramma di Siggard Andersen (vedi fig), mentre fornisce un mezzo eccellente per spiegare le cause differenti di disturbo dell’equilibrio acido-base nella vita postnatale, non è molto utile in medicina fetale. Dopo tutto, quasi ogni disturbo dell’equilibrio acido-base antenatale è la conseguenza di scambi placentari insufficienti e quindi è paragonabile all’acidosi respiratoria primaria del bambino o dell’adulto durante un episodio di soffocamento (22,23).
Il soffocamento è seguito da una complessa serie di eventi interattivi che non sono del tutto spiegati a livello molecolare .
La prima spiegazione è l’accumulo di CO2 che è prodotto in grandi quantità. Subito dopo, l’aumento della pCO2 e la diminuzione di pO2 determinano lo spostamento del metabolismo aerobio ad anaerobio con conseguente accumulo di acidi fissi in particolare acido lattico.
Nel momento in cui la funzione placentare si ristabilisce, la maggior parte di CO2 rapidamente attraversa la placenta, mentre gli acidi non volatili sono intrappolati per un tempo più lungo.
Normalmente l’acidemia fetale è di natura combinata: respiratoria e metabolica. Sicuramente non è mai riscontrato nel feto la classica acidosi metabolica dell’adulto con compenso respiratorio.
Molti autori classificano i risultati delle misurazioni acido-base nel feto in quattro categorie :
1) normale
2) acidosi respiratoria
3) acidosi metabolica
4) acidosi combinata respiratoria/metabolica.
La maggioranza degli studi dimostrano una buona correlazione tra BE e pH (21) e in questi studi l’acidosi respiratoria pura e l’acidosi metabolica pura sono infrequenti.
Tuttavia in altri studi circa il 20 % dei casi sono inquadrabili in queste categorie "pure"(24,25).
La classificazione di cui sopra dipende dai valori di pCO2 che hanno, tra l’altro, un alto coefficiente di variazione e valori di cut-off artificiosi, per cui, in realtà, la definizione di acidosi metabolica e respiratoria è imprecisa.
Inoltre bisogna tener presente che la causa dell’ asfissia fetale è quasi sempre una diminuzione della circolazione placentare sia sul lato materno che su quello fetale.
Pertanto pare, che la distinzione tra acidemia metabolica e respiratoria fetale non sia molto produttiva.
Questo è ben dimostrato nel lavoro di Vandebusshe (12) dove viene studiata una serie di 30 neonati con un pH dell’arteria ombelicale (UA pH) < 7, di questi, solo 2 neonati (con un BE di 11.4 e 11.6 mmol/l) si sono presentati con un’acidosi respiratoria secondo le definizioni più comunemente usate.
Entrambi i neonati avevano un pH della vena ombelicale > 7.20.
Rimane la questione di quali casi la pCO2 aiuta a determinare il grado di rischio nei feti con pH ugualmente basso.
Alla nascita una pCO2 elevata nel cordone ombelicale indica che una adeguata ventilazione può subito ristabilire l’omeostasi. Tuttavia, suggerire che un’ acidosi respiratoria sia innocua potrebbe essere una forma di eccessiva semplificazione come dimostrato in uno studio (26,27) in cui si indicava che un valore elevato di pCO2 era uno dei parametri più specifici e sensibili per identificare l’encefalopatia ipossico-ischemica e lo sviluppo anomalo in un gruppo di bambini con pH dell’arteria ombelicale < 7 (26,27).
1.3.2 Il lattato nella medicina fetale e perinatale
La concentrazione media di lattato nel feto sano è di 1 mmol/l (28).
Durante il travaglio e soprattutto durante il periodo espulsivo il lattato plasmatico aumenta rapidamente sia nel feto che nella madre (29).
Mentre l’incremento del lattato plasmatico nella madre è il risultato delle contrazioni uterine e muscolari, l’origine dell’aumento del lattato fetale è molto meno ovvio.
Il lattato fetale può essere parzialmente di origine materna o può essere prodotto dalla placenta.
Nel normale travaglio vi è una ottima correlazione tra la concentrazione del lattato nel sangue arterioso materno e il sangue della vena ombelicale.
Esperimenti su scimmie hanno dimostrato che il lattato radioattivo diffonde rapidamente dalla madre al feto così come dal feto alla madre (30).
La placenta nella gravidanza avanzata produce normalmente lattato per il feto, in quantità sufficienti per coprire il 25% del metabolismo ossidativo fetale(31,32).
Il lattato è anche prodotto dal feto e viè una associazione direttamente proporzionale tra distress fetale e iperlattaticemia. Il lattato plasmatico aumenta nella iperglicemia mediata dalle catecolamine.
Infine la ipossiemia fetale aumenta la concentrazione cellulare di lattato secondo la seguente reazione mediata dall’ LDH:
Lattato + NAD+ ↔ piruvato + NADH + H+
Dopo di ciò, il lattato diffonde facilmente nel fluido extracellulare.
I valori normali medi nel sangue dell’arteria ombelicale dopo la nascita sono di circa 3.0 mmol/l, con valori sopra i 6.0 mmol/l statisticamente anormali (33).
Il coefficiente di variazione per questa misura varia tra 1.7 e 8.4% (34).
È noto dalla letteratura pediatrica che valori sopra i 15 mmol/l sono chiaramente predittivi di un outcome sfavorevole (35,36,37).
Vi sono alcuni argomenti validi per l’uso della misurazione del lattato in medicina fetale rispetto alla misurazione del pH. Ad esempio è sufficiente solo metà quantità di sangue per la misurazione del lattato rispetto a quella del pH, il che potrebbe anche ridurre il numero di fallimenti di prelievo di sangue fetale durante il travaglio di parto. Inoltre, rispetto alla misurazione del pH è anche dimezzato il costo della misurazione del lattato durante il travaglio e durante il parto.
L’economicità e la semplicità di questa misurazione potrebbe certamente aumentare la sua accettabilità.
Però prima che il lattato possa diventare uno strumento valido di utilizzo in medicina perinatale, la misurazione necessita di una migliore validità clinica.
In più deve essere data una risposta ad una serie di questioni fondamentali; prima di tutto la quota di lattato di origine materna e placentare rendono più difficile l’interpretazione del lattato fetale e perinatale. Per es. nella medicina pediatrica il lattato non è la causa del danno cellulare né il segno più diretto di ischemia.
Si potrebbe facilmente argomentare (vedi l’equazione di cui sopra) che l’aumento del lattato derivi da un’aumento della concentrazione degli ioni H+ . Effettivamente il lattato del sangue del cordone (che costituisce approssimativamente il 40% del BE) correla anche bene con il pH (38).
Nel 1964 Derom propose di applicare le idee di Huchabee, sull’eccesso di lattato, alla medicina fetale e introdusse la differenza tra eccesso di lattato materno ed eccesso di lattato fetale come una misura della asfissia fetale (28,29).
Invece di confrontare sangue materno con sangue fetale, si potrebbe semplicemente valutare il sangue venoso e arterioso del cordone per confrontare la differenza tra eccesso di lattati nel sangue della vena e nel sangue dell’arteria ombelicale usando la seguente equazione:
∆ C L = (La – Lv) – (Pa – Pv) (Lv / Pv)
Pur tuttavia, essendo la differenza di eccesso di lattati materno-fetale un interessante idea, in realtà, non è mai stata utilizzata negli studi perinatali, tanto meno in applicazioni cliniche.
1.4 Conclusioni
Dopo aver indicato brevemente le evidenze e i vantaggi dell’utilizzo del BE o del lattato come misure del benessere fetale, forse non si dimostrano molto attendibili.
Probabilmente è poco realistico sperare che misure ancora più complicate come il BE e il ∆ C L possano essere indici migliori di ischemia fetale rispetto al pH misurato sul sangue fetale.
Merita maggiore attenzione la ricerca di una relazione tra la concentrazione plasmatica di altre sostanze (per es. gli enzimi intracellulari, gli ioni, gli aminoacidi, gli ormoni) e il danno cellulare.
Vi sono stati studi sulla relazione tra l’asfissia fetale e, per esempio, la creatininfosfochinasi (CK), la lattato-deidrogenasi (LDH), l’idrossibutirrato-deidrogenasi, le ipoxantine, ioni Ca++ e l’eritropoietina (39,37).
Nel futuro sembra che il pH del sangue fetale continui a rappresentare un metodo semplice e attendibile per una definizione biochimica di asfissia fetale.
Per differenziare ulteriormente i tipi di acidosi, lo strumento più ovvio sembra essere la differenza arterovenosa di pH nel sangue del cordone, dove esistono perciò chiare radici fisiologiche (40).
Ad esempio se il pH del sangue dell’arteria ombelicale è < 7 ed il pH del sangue della vena ombelicale è normale siamo di fronte ad una occlusione acuta del cordone ombelicale; mentre quando è basso anche il pH ematico della ombelicale siamo di fronte ad un’acidemia esistente da più tempo con una prognosi più riservata (41), oppure ad un distacco di placenta (42).
Secondo la maggioranza degli autori il pH del sangue fetale e il pH del sangue dell’arteria ombelicale restano attualmente le misurazioni più attendibili e clinicamente importanti per la determinazione della asfissia fetale. In più il pH del sangue della vena ombelicale dà informazioni ulteriori sul compenso placentare nei casi di acidemia fetale ( 21,40).
Né l’eccesso basi (BE) né il lattato al momento attuale rappresentano uno strumento migliore per definire biochimicamente l’asfissia fetale (12).
BIBLIOGRAFIA
CAPITOLO 2
ASFISSIA SPERIMENTALE PERINATALE *
La regolazione dello stato acido base è essenziale per il funzionamento di ogni organismo vivente.
Il pH intracellulare umano è mantenuto attivamente intorno a 6.8 (ciò equivale a neutralità a 37oC ) (1) .
Il mantenimento del pH intracellulare intorno a valori neutrali è essenziale per mantenere lo stato di ionizzazione degli aminoacidi residui e quindi di riarrangiamento terziario delle proteine strutturali e degli enzimi.
Un pH intracellulare neutrale è anche necessario per mantenere la ionizzazione e la solubilità in acqua dei metaboliti.
Al fine di mantenere un pH neutrale la cellula necessita di sistemi tampone che limitano l’impatto di liberazione improvvisa di ioni H+
.
*Basato su: Vandenbussche F.P.H.A. in: Studies on the clinical significance of fetal blood pH. Katholieke Universiteit Leuven, België 1999
I liquidi cellulari ed extracellulari contengono tre importanti sistemi tampone :
Negli organismi complessi multicellulari, il sangue costantemente rinnova il fluido extracellulare, pertanto produce un ambiente finalizzato a mantenere la neutralità acido-base (indispensabile per mantenere la vita cellulare).
Mentre il rapporto intracellulare OH+ / H+ è intorno a 1, il rapporto extracellulare di OH+ / H+ è intorno a 20 (1).
La concentrazione degli ioni H+ nel plasma ha un pH di 7.4 , è cinque volte inferiore rispetto alla concentrazione intracellulare di ioni H+ (pH 6.8), questo gradiente sembra essenziale per una funzione ottimale di scambio.
Dopo la nascita il mantenimento del pH è assicurato dai polmoni e dai reni, mentre prima della nascita, il pH del sangue fetale è mantenuto dall’omeostasi materna e da una placenta funzionante.
Un’aumento di produzione di metaboliti acidi o una temporanea diminuzione della eliminazione della CO2 e di altri prodotti finali del metabolismo cellulare, risulta in una di munizione del pH del sangue fetale.
Questa diminuzione è, quasi sempre, rapidamente reversibile quando è ristabilita una appropriata liberazione della CO2 .
Un’altra causa di acidemia è la liberazione, nella circolazione, di prodotti cellulari acidi dovuti a modifiche della membrana cellulare.
Queste modifiche possono essere il risultato di una compromissione temporanea o di un danno permanente alle funzioni cellulari.
L’ischemia è una causa importante di danno cellulare, anche se una acidemia grave, di per se, potrebbe essere una causa addizionale di danno alle altre cellule.
Tuttavia, la causa maggiore di danno cellulare secondario,è probabilmente associata all’accumulo locale di aminoacidi, prostaglandine vasoattive e radicali liberi.
L’acidemia dovrebbe essere vista, soprattutto, come un segno di una omeostasi che si sta collassando, mentre il suo ruolo nel causare, in vivo, un danno secondario è probabilmente limitato.
La diminuzione del pH ematico è un segno di una insufficienza circolatoria e nel feto è uno dei pochi segni che siamo in grado di monitorare.
La questione rimane con quale accuratezza il pH del sangue fetale riflette gli eventi avversi primari che minacciano il feto.
Al fine di rispondere a questo quesito sono stati eseguiti esperimenti sulla pecora e sulla scimmia.
Richardson et al. studiarono 9 pecore, producendo occlusioni ripetute del cordone ombelicale della durata di 1 minuto ogni 5 minuti per 1 ora.(2)
Il risultato fu una decelerazione della frequenza cardiaca fetale a circa 90 battiti per minuto durante gli ultimi 30 secondi dalla occlusione.
Il pH del sangue fetale nell’arteria brachiocefalica diminuiva (valori medi) da 7.36 a 7.33 dopo la prima occlusione e misurava 7.26 (range tra 7.35 e 7.15) dopo un’ora (2).
Nello stesso esperimento il lattato aumentava da 1 a 4 mmol/l dopo un’ora.
Bergmans et al. hanno studiato 5 pecore applicando occlusioni ombelicali ripetute di 2 minuti ogni 5 minuti per 1 ora (3).
Il pH medio ematico dell’arteria femorale nel feto era di 7.27 all’inizio dell’esperimento.
Vi era una caduta media 0.7 unità di pH ad ogni occlusione con un recupero quasi completo tra un collusione e l’altra. Tre minuti dopo l’ultima occlusione, il pH medio dell’arteria era di 7.17.
Adamson e Myers studiarono otto feti di scimmia dopo costrizione intrapartum dell’aorta addominale materna (4). Per le iniziali 3 ore si manteneva una costrizione che era in grado, ma non completamente, di scatenare le decelerazioni tardive.
Durante la 4o ora la costrizione veniva aumentata in modo da causare decelerazioni tardive fino al 15% della frequenza cardiaca iniziale.
Il pH medio dell’aorta addominale fetale era di 7.28 (range 7.21, 7.32) durante il periodo di controllo, di 7.16 (range 7.8, 7.22 ) alla fine delle prime 3 ore, e di 7.13 (range 7.5, 7.17) alla fine della 4o ora.
Un esame clinico neurologico degli 8 neonati non era in grado di dimostrare alcuna anomalia (3).
L’esame anatomico a 3 mesi e fino a 9 mesi dopo il parto di campioni del cervello di tutti gli 8 animali non permetteva di riscontrare alcuna anomalia o patologia.
Questo studio può essere concluso affermando che, i feti di scimmia a termine di gravidanza possono sopportare un’asfissia moderata senza lesioni al SNC (4).
Bisogna però precisare che gli animali erano anestetizzati e che si è provveduto ad evitare ogni insulto asfittico addizionale sia al parto che nel periodo neonatale.
È in generale noto che l’anestesia con barbiturici aumenta significativamente la tolleranza del feto all’asfissia (5).
Gunn et al. hanno studiato 22 feti di pecora di cui 3 morirono di infezione e vennero esclusi dall’analisi (6).
Essi applicarono una occlusione parziale (finchè il contenuto di ossigeno del sangue arterioso scendeva al di sotto di 1.5 mmol/l ) o totale dell’arteria uterina, finchè i voltaggi elettroencefalografici dei neonati erano ridotti a meno del 20 % della linea di base. Tutto ciò in un periodo da 30 minuti fino a 130 minuti.
Ne risultò che cinque feti morirono, tre giorni dopo, i sopravvissuti venivano sacrificati per un esame istologico del cervello.
Prima della occlusione il pH medio del sangue arterioso fetale era di 7.37
Dopo la occlusione i risultati erano i seguenti:
Il danno neuronale era fortemente associato con il grado di diminuzione della pressione del sangue e del pH durante l’insulto ma non il grado di ipossia (6).
Il pH cadeva fino a meno di 7 in sei degli otto feti con danno neuronale, invece rimaneva a più di 7 nei cinque di quei feti senza danno.
La maggior parte delle cellule neuronali danneggiate risiedeva nella corteccia parasagittale e nel nucleo striato.
Nel 1975 Ronald Myers presentava un riassunto di gran parte del suo lavoro sperimentale, descrivendo quattro modelli di danno cerebrale perinatale (7).
Il primo modello si presentava dopo improvvisa e completa occlusione del cordone ombelicale. Nei primi 12-15 minuti di questa improvvisa "asfissia totale" il pH del sangue fetale si riduceva continuamente (corrispondente con un aumento logaritmico di ioni H+ ) da 7.30 a 6.8 (0.04 unità di pH per minuto).
Tra 5 e 12 minuti dopo il clampaggio del cordone ombelicale i feti di scimmie a termine di gravidanza facevano una serie di movimenti respiratori tipo gasping con una frequenza tra 5 e 10 gasper per minuto.
Nel feto profondamente anestetizzato erano necessari 12-13 minuti di "asfissia totale"per produrre il primo segno di danno cerebrale.
In seguito più prolungata era la asfissia più consistente era il danno.
La struttura più vulnerabile era il nucleo centrale del collicolo inferiore, seguito dall’oliva superiore, dalle cellule di Purkinje del cervelletto e dai nuclei vestibolari e talamici (7).
In questi animali rianimati, però, "l’asfissia totale", che durava approssimativamente oltre i 20 minuti, portava comunque alla morte per shock cardiogeno entro ore o giorni (7).
Il secondo modello era stato denominato "asfissia parziale" o "asfissia acidotica" e avveniva dopo varie manipolazioni sulla madre ( per esempio, causando in essa una ipotensione o iperstimolazione della muscolatura uterina ) in modo da causare un calo del contenuto di ossigeno nel sangue fetale di circa 10 vol % fino a meno di 1.5 a 0.8 vol % per almeno 30 minuti (7).
Cambiamenti meno importanti potevano essere tollerati per periodi prolungati senza produrre alcuna evidenza di danno cerebrale, mentre cambiamenti più importanti portavano a morte rapida.
Queste manipolazioni causavano nel feto una grave acidosi mista respiratoria e metabolica.
Dopo la nascita, questi animali presentavano una postura decerebrata e convulsioni.
L’esame post morte rivelava estese necrosi corticali.
Livelli simili di asfissia ed encefalopatia erano stati riportati da Ball et al. dopo occlusione parziale del cordone (80%) per 90 minuti in sei feti ovini (8).
Il terzo modello descritto da Myers et al. era definito"ipossia oligoacidotica" e portava a lesionidella materia bianca (emorragiche), soprattutto delle regioni prefrontali e posteroparietali (7).
Tali lesioni della materia bianca erano state osservate nei feti nati morti nel terzo trimestre e dopo distacco parziale (sperimentale) di placenta.
Myers dimostrò, in esperimenti di laboratorio, che è possibile produrre queste lesioni riducendo gradualmente gli scambi gassosi respiratori mantenendo la pO2 a livelli così bassi da 8 a 10 mmHg per lunghi periodi.
Una situazione di questo tipo può essere mantenuta senza chiaramente influenzare alcun segno vitale del feto e senza diminuzione significativa di pH nel sangue arterioso fetale.
Pertanto sembra che ci sia una condizione ipossica che conduce ad emorragia della materia bianca dove il feto non evidenzia alcune indicazioni di trovarsi effettivamente in una situazione di stress. In questi casi l’iperventilazione della madre può giocare un ruolo nel prevenire l’acidemia fetale.
In esperimenti di scimmie giovani sottoposte ad inalazioni di monossido di carbonio, si riuscì a trovare nella materia bianca un ulteriore supporto per questa presunta relazione tra la lesione della materia bianca e la "ipossia oligoacidotica"(8).
Il quarto ed ultimo modello descritto da Myers è una combinazione di "asfissia parziale e totale"(7).
Questa combinazione portava tipicamente a lesioni dei gangli basali (nuclei caudati, putamen e globo pallido).
In più i feti soffrivano di un danno variabile alle aree corticali (dovuto alla componente di "asfissia parziale") e al tronco encefalico(dovuto alla componente dell’asfissia totale).
Questi cambiamenti avvenivano quando questi animali già evidenziavano una acidemia moderata o severa, quando esposti ad una asfissia per periodi di 5 fino a 10 minuti.
Gli esperimenti descritti sopra, danno informazioni preziose sulla reazione fetale quando è disturbato lo scambio gassoso.
La stessa reazione probabilmente avviene nel feto umano (9) il che induce a fare alcune considerazioni:
A tale proposito vi sono studi statistici basati sulla media di – 3 SD del pH dell’arteria ombelicale in una popolazione normale (10) che coincide con la distribuzione non gaussiana del pH dell’arteria ombelicale in un gruppo di neonati (43). Un lavoro di Goescen, basato sul contributo materno alla acidemia fetale, sottolinea la mancanza di tale contributo nel caso i cui il pH del sangue fetale sia inferiore a 7.00 (11).
In fine, vi è lo studio epidemiologico proposto da Van De Riet et al. basato sulla massima odds ratio che è associata ad un cut-off di 7.00 (12). È inotre uno studio che si è rivelato utile nella medicina dell’adulto.(13)
A questi lavori possiamo aggiungere l’evidenza derivata gli esperimenti animali di cui sopra (7,3,6).
Esiste evidenza che solo il 20 % dei bambini con paralisi cerebrale hanno dimostrato segni di asfissia perinatale, questo dato è emerso da studi prospettici (15,16), da studi caso controllo ed esemplificato in indicazioni casistiche (17).
In un certo numero di questi bambini i segni di asfissia potevano essere solo casuali e la paralisi cerebrale può aver avuto origine da altre cause che non sono perinatali.
Ciononostante, noi sappiamo che l’asfissia perinatale esiste e questi esperimenti ci indicano che l’asfissia perinatale, in feti altrimenti non danneggiati, può causare i difetti cerebrali e i sintomi di una paralisi cerebrale.(7).
Ciò che preoccupa di più, in questi esperimenti animali, è la probabile esistenza di una forma insidiosa di ipossia cronica (descritta da Myers come "asfissia oligoacidotica") che produce lesioni della materia bianca senza influenzare i segni vitali del feto e senza significativa diminuzione del pH del sangue fetale (7).
Dovrebbe essere chiaro a tutti, tuttavia, che una misurazione unica è raramente accurata e rilevante al 100% .
Gli esperimenti di Nakamura et al. ci danno un esempio eccellente in questo contesto (18). In sei agnelli fetali sani è stato iniettato cloruro di potassio al fine di provocare una asistolia cardiaca. In assenza di flusso ematico, il pH dell’arteria ombelicale rimaneva invariato dall’inizio fino a 20 minuti dopo l’inizio della asistolia (18).
Molti di questi esperimenti erano eseguiti sotto anestesia con barbiturici che,come è noto, proteggono l’animale dal danno cerebrale (5).
Ciononostante è piuttosto impressionante che i feti dimostravano una tolleranza all’asfissia più grande di quanto ci si aspettava da animali giovani o adulti in condizioni uguali .
Gli esperimenti eseguiti su ratti di 3 settimane di vita e ratti neonati, dimostravano che in questi ultimi, la tolleranza all’anossia ere 10 volte superiore rispetto ai ratti di 3 settimane (19).
La capacità del cervello fetale nell’utilizzare lattati e corpi che tonici, come substrato energetico, e la capacità più elevata dell’emoglobina fetale di legare l’ossigeno, possono giocare un ruolo fondamentale in questo fenomeno.
In fine, questi esperimenti, dimostrano una grande variabilità interindividuale in risposta all’asfissia .
Ovviamente la realtà clinica in ostetricia è di gran lunga più complessa di questi esperimenti ben controllati.
Molte circostanze possono rendere un feto più vulnerabile; non è stato affrontato, per esempio, il ritardo di crescita intrauterino negli esperimenti su animali.
Tuttavia le evidenze di questi esperimenti, se pur crudeli, offrono informazioni valide e punti di riferimento importanti sia per i ricercatori che per i clinici.
BIBLIOGRAFIA
CAPITOLO 3
ASFISSIA PERINATALE
"É irrazionale pensare che un bambino cerebroleso lo sia a causa del travaglio o del parto, senza considerare altri fattori.
Il danno cerebrale puó verificarsi senza un travaglio difficoltoso e senza ipossia perinatale e il taglio cesareo non mette al riparo da questa.
Gravi difficoltá nel travaglio e gravi ipossie durante il parto, nella grande maggioranza, non sono seguite da danno cerebrale.
Nella storia delle madri di questi bambini, invece, vi é una piú alta incidenza di infertilitá relativa, di gravidanza con nati di basso peso e ritardata crescita intrauterina, con nati postmaturi, o risultano emorragie in gravidanza, gestosi, infezioni. Spesso vi sono fattori genetici, vi sono piú malformazioni congenite e risultano patologie secondarie. Si tratta di interazioni tra numerosi fattori prenatali, perinatali e postnatali ed é molto semplicistico ascrivere la lesione cerebrale ad un singolo fattore come il parto podalico o l’ipossia alla nascita,senza considerare le cause antecedenti a questi fattori"
R.S.Illingworth
2.1 Definizioni
Il termine asfissia è derivato dal greco a-sphygmos e significa senza polso.
Dorland definisce asfissia uno stato di mancanza di ossigeno nell'aria inspirata risultante in una immediata o attuale cessazione di vita apparente (1).
La definizione accettata dalla National Library of Medicine (NLM) degli Stati Uniti concorda con quella di Dorland, secondo questa definizione uno scambio insufficiente di gas e la mancanza di ossigeno nelle cellule, causa la cessazione del polso.
Naturalmente si intende anche che un’ individuo in stato di asfissia che non sia ancora deceduto può essere salvato con manovre di rianimazione. Pertanto è chiaro che anche una situazione seria come l’asfissia, comporta livelli diversi di gravità. Per esempio uno stato di asfissia appena insorto può talvolta essere facilmente e completamente reso reversibile, mentre una asfissia di durata più lunga può causare un danno d’organo irreversibile.
L’Organizzazione Mondiale della Sanità (OMS) definisce, nella Decima Revisione della Classificazione delle Malattie (ICD-10), "Asfissia da parto" due diverse condizioni: severa (P21.0) e lieve o moderata (P21.1) (2).
Una respirazione assente o altri problemi respiratori sono cruciali nella definizione dell’OMS come asfissia da parto: "Questa categoria non deve essere utilizzata come punteggio di Apgar basso senza menzione di asfissia o altri problemi respiratori. Non è chiaro perché la definizione dell’OMS trascura certi elementi del punteggio di Apgar. La definizione P21.0 non considera la risposta alla stimolazione, mentre la definizione P21.1 non considera il colorito.
Tutte le definizioni di cui sopra, sono interamente basate sui segni clinici.
La terza edizione del Dizionario di Webster, (3) d’altra parte dà la seguente definizione: "Mancanza locale o sistemica di ossigeno ed eccesso di biossido di carbonio nei tessuti viventi, generalmente come risultato di una interruzione della respirazione".
Anossia o soffocamento sono considerati sinonimi in senso molto lato (3).
È considerevole che tale definizione sebbene molto simile a quella di Dorland, sia interamente basata su misure biochimiche.
L’idea di definire l’asfissia in termini biochimici è stata appoggiata da molti ricercatori che hanno proposto una grave acidemia come la migliore misura (4,5,6).
Siccome l’asfissia può condurre a danno cerebrale, questo termine è stato sorgente di molti malintesi in particolar modo se viene applicata la definizione dell’OMS.
L’American Collage of Obstetrics and Gynecologists (ACOG) e l’American Accademy of Pediatrics hanno criticato l’utilizzo del punteggio di Apgar ad 1 minuto per definire l’asfissia da parto, nel tentativo di chiarire questo concetto e di frenare le alluvioni di denuncie risultanti da questo malinteso (7).
Un bollettino tecnico ACOG del 1989 afferma che "Il punteggio Apgar è inappropriato per definire l’asfissia e che la stessa implica ipossiemia (e normalmente ipercapnia) di grado tale da portare ad una acidosi metabolica" (8).
Il bollettino tecnico ACOG affrontando le lesioni neurologiche fetali e neonatali ed emesso all’inizio del 1992, (6) afferma che "L’asfissia deve essere quasi letale per essere considerata una possibile causa di paralisi celebrale…, per dimostrare una possibile relazione tra l’asfissia perinatale e il deficit neurologico in un singolo paziente tutti i seguenti criteri devono essere presenti prima che possa essere stabilito un nesso plausibile:
Più tardi nello stesso anno l’ACOG addirittura affermò che "Il termine asfissia da parto è generico e impreciso e non dovrebbe essere usato" (7).
Queste affermazioni sono state riportate abbastanza spesso ed alcuni autori sono addirittura arrivati al punto di insistere che tutti i quattro criteri menzionati su, siano presenti prima di utilizzare il termine di asfissia (9).
È da notare che l’ACOG richiedeva questi criteri soltanto per una definizione di asfissia quasi letale per essere quanto più vicini alle definizioni della NLM. Sfortunatamente la prima parte della definizione della NLM di asfissia (mancanza di ossigeno nell’aria inspirata) non è rilevante in medicina fetale.
Sarebbe meglio per es. definire l’asfissia in termini più generali come è stato fatto da Phibbs: "L’asfissia avviene quando l’organo adibito agli scambi gassosi fallisce" (10).
Tuttavia in questa tesi viene utilizzata, per asfissia fetale o perinatale, la seconda parte della definizione della NLM cioè "Una condizione di minaccia o attuale cessazione di vita apparente". Tale definizione è vicina alla origine etimologica della parola e chiara sia agli esperti che alle persone comuni e riflette l’acuta minaccia presente in questa situazione clinica.
2.2 Fattori che interferiscono con l’ossigenazione fetale
Come già affermato dall’ACOG il termine "Asfissia alla nascita" è impreciso poichè sinonimo di arresto assoluto di flusso ematico uterino o fetale, come invece raramente accade durante il travaglio di parto.
Molto più frequentemente nella pratica clinica si osservano eventi che portano allo sviluppo graduale di ipossia e ipercapnia che, se prolungati nel tempo risultano in acidemia metabolica.
Il feto ha bisogno di ossigeno, il suo consumo è due volte superiore a quello di un adulto (6 ml/Kg/min.).
Il principale problema metabolico che può interessare il feto sia nel corso della gravidanza sia durante il parto, è la deplezione di ossigeno.
Tutti gli scambi gassosi del feto avvengono attraverso la placenta, che funziona da polmone.
La qualità degli scambi dipende direttamente dal flusso utero-placentare e dal flusso ombelicale.
Nella maggior parte dei casi, l’ipossia fetale è dovuta ad un ridotto afflusso di sangue dal distretto placentare al feto, come avviene nella riduzione della superficie di scambio in caso di IUGR o di distacco di placenta e nella riduzione della perfusione ematica placentare in caso di ipertono uterino.
Vi sono poi quelle condizioni patologiche a carico della camera intervillosa, quali infarti o lesioni trombotiche o anomalie anatomiche che determinano una riduzione del volume della camera intervillosa e quindi una limitazione della riserva di ossigeno a disposizione del feto.
Il flusso ombelicale può risultare ridotto, pur in presenza di una buona perfusione e ossigenazione placentare, in caso di compressione o stiramento del cordone o in caso di emorragia delle inserzioni velamentose del cordone (emorragie di Benkiser).
Naturalmente anche le condizioni materne possono interferire con l’ossigenazione fetale, a causa di un insufficiente apporto di sangue ossigenato alla placenta, questa insufficienza può essere cronica o acuta.
Nell’insufficienza cronica le lesioni placentari riducono gli scambi come avviene nella ipertensione materna indotta dalla gravidanza, nel diabete e nella gravidanza protratta.
Nell’insufficienza acuta sono presenti alterazioni emodinamiche localizzate o sistemiche quali:
· La sindrome ipotensiva da decubito che, riducendo la gittata cardiaca e aumentando le resistenze periferiche, può far diminuire il flusso utero-placentare, anche in assenza di grandi variazioni della pressione arteriosa materna.
· L’effetto Poseiro: consiste in una contrazione uterina che determina una variazione di posizione dell’utero e la compressione dell’aorta addominale materna. Questo fenomeno si manifesta durante una contrazione uterina con la scomparsa, nel 30% dei casi, di una o di ambedue i polsi femorali e conseguente riduzione dell’apporto di sangue per un periodo di tempo superiore a quello provocato dalla contrazione uterina (11).
La contrazione uterina fisiologica determina un aumento della pressione intramiometriale ed un aumento della pressione intrauterina(13); le quali determinano, in un primo tempo, una occlusione venosa, così il sangue è intrappolato nella camera intervillosa e la pressione intervillosa aumenta leggermente.
In seguito, quando la pressione sviluppata dalla contrazione uterina supera la pressione in entrata, l’apporto di sangue viene interrotto .Questa interruzione dura in totale non più di 10-20 secondi ed è proporzionale all’intensità e alla durata di una contrazione uterina normale.
Generalmente, la riduzione dell’apporto arterioso alla camera intervillosa è modesta .la camera intervillosa rappresenta una riserva di ossigeno per il feto e le variazioni emodinamiche, dovute alla contrazione, non turbano affatto la captazione da parte del feto dell’ossigeno contenuto in questa riserva.
Inoltre le fasi di rilassamento tra le contrazione permettono la ricostituzione di questa riserva di ossigeno.
Diversamente sono da considerare le anomalie della contrazione uterina, in quanto, compromettono la ricostituzione della "riserva " di ossigeno della camera intervillosa.
Si tratta di ipercinesie ed espressione della lotta dell’utero contro un ostacolo, si osservano, in genere, nei casi di sproporzione cefalo-pelvica.
La sonmministrazione intempestiva di ossitocici è solo eccezionalmente chiamata in causa.
Distinguiamo:
2.3 Conseguenze dell’ipossia*
In caso di ipossia, il feto reagisce dapprima mantenendo l’ossigenazione dei propri organi vitali, ovvero il cervello, il cuore, i surreni e la placenta, grazie al compenso attuato con diversi meccanismi.
· Compenso cardio-circolatorio
Dipende dal sistema nervoso autonomo (14,15).
L’ipossia stimola inizialmente i chemiorecettori situati nell’aorta ascendente che stimolano il parasimpatico: in questo modo la frequenza diminuisce con conseguente stimolazione del Simpatico che determina una vasocostrizione periferica ed un aumento della pressione arteriosa.
L’ipertensione arteriosa, per un difetto di maturazione dei chemiocettori e del parasimpatico, non si osserva prima del terzo trimestre di gravidanza nonostante l’aumento delle resistenze vascolari periferiche. L’ipertensione arteriosa stimola a usa volta i barocettori situati alla base dell’aorta ed a livello del seno carotideo, provocando bradicardia fetale. In realtà, l’effetto sul ritmo cardiaco dipende da diversi fattori: azione diretta dell’ipossia, attività delle catecolamine circolanti, azione sul nodo sinusale, che dipende essa stessa dalla stimolazione dei barocettori e chemiocettori, dalla ossigenazione dei centri bulbari e dalla risposta a stimolazioni corticali e sotto-corticali.
La bradicardia facilita la stimolazione cardiaca, allungando la diastole. La contrattilità del miocardio è aumentata. Inoltre, il cuore fetale possiede una notevole riserva di glicogeno che gli consente di resistere meglio all’ipossia ed un patrimonio enzimatico che favorisce la glicolisi anaerobica. Il cuore funziona però al massimo delle proprie possibilità: la gittata cardiaca non può aumentare in caso di anossia, e ciò rende necessaria una ridistribuzione della massa ematica a favore degli organi vitali e del mantenimento del flusso del cuore sinistro.
Tutti gli studi condotti sull’animale da laboratorio dimostrano che la vasocostrizione periferica interessa i reni, l’intestino, la milza, lo scheletro, i muscoli e la cute (16).
Il flusso sanguigno diminuise in questi organi, consentendo una ridistribuzione del flusso cardiaco negli organi nobili, essenzialmente cervello e cuore, ma anche i surreni e la placenta. Il fabbisogno di ossigeno diminuisce ma, nelle zone non privilegiate, l’ipossia compromette il metabolismo energetico del feto, modificando le condizioni di utilizzazione del glucosio. Il feto utilizza allora la via anaerobica, alla quale, il suo sistema enzimatico è adattato. L’ipossia, però, ostacola il trasporto placentare del glucosio, che è ossigeno-dipendente, trasporto, del resto, già limitato dalla riduzione del flusso utero-placentare. Il feto può dunque trovare il glucosio solamente nelle sue risrve di glicogeno, che mobilizza aumentando la secrezione di corticotropina e di cortisolo, riducendo la secrezione di insulina ed aumentando la secrezione di catecolamine (17).
Le riserve di glicogeno, che sono soprattutto epatiche, cardiache e renali, si esauriscono rapidamente; il feto prematuro possiede maggiori riserve del feto a termine, come pure quello normo-trofico rispetto all’ipotrofico: ciò spiega perché l’ipotrofico ed il post-termine sono così sensibili. Durante le fasi di ipossia moderata, il consumo di ossigeno miocardico e cerebrale è mantenuto; quando l’asfissia diventa grave, il consumo di ossigeno non è più possibile; i meccanismi di protezione vengono sopraffatti. Si instaura una intensa vasocostrizione del letto vascolare, che rappresenta il momento di scompenso a partire dal quale compare probabilmente la bradicardia finale, l’ipotensione ed il decesso. E’ in questa fase di scompenso che si sviluppano le lesioni d’organo.
· Compenso cerebrale
Resistenza relativa del cervello all’ipossia
Il cervello fetale consuma più ossigeno del cervello di un adulto, all’incirca il 50% in più ma resiste meglio all’ipossia, probabilmente grazie a due meccanimi: la capacità del cervello di ritardare, nell’ipossia, il passaggio del K+ intracellulare nello spazio interstiziale e la maggiore capacità di fabbricare ATP in anaerobiosi.
La tolleranza all’ipossia è tuttavia difficile da quantificare. Inizialmente, quando compare la asfissia, un processo di autoregolazione mantiene una circolazione cerebrale normale, se non aumentata (18). Questo processo di autoregolazione ha un’origine metabolica biogena e neurogena; intervengono fattori vasoattivi, quali, gli ioni H+, Ca++ , l’adenosina, le prostaglandine e l’osmolarità. Il flusso aumenta maggiormente a livello del tronco cerebrale ed in misura minore a livello del cervelletto, ma soprattutto, della materia bianca della corteccia parietale para-sagittale, in particolare, a livello dell’interfaccia delle branche terminali delle arterie cerebrali medie ed anteriori (19). Per tale motivo queste zone sono maggiormente sensibili.
In un secondo momento, l’autoregolazione tra pressione arteriosa e flusso cerebrale viene a mancare; se l’acidosi è severa (pH < 7) e prolungata, il flusso sanguigno a livello cerebrale non aumenta più, torna alla normalità, o addirittura si riduce.
Due sono le cause di questo fenomeno: in queste condizioni si instaura una insufficienza miocardia, quindi il flusso cerebrale diminuisce con l’ipotensione; esisterebbe peraltro un deficit della regolazione della motilità vascolare cerebrale, e quindi dell'autoregolazione.
La perdita dell’autoregolazione vascolare dura più a lungo dell’ipossia; nel caso di un’ipossia che duri 20 min., e nonostante il ripristino del normale apporto di ossigeno, bisogna attendere 7 ore prima di tornare a condizioni di autoregolazione normali. E’ durante la fase di riperfusione che il rischio di sviluppare lesioni emorragiche nei territori compromessi dai disturbi metabolici è maggiore.
Non si sa dopo quanto tempo compaiano le lesioni cerebrali; questo intervallo di tempo varia probabilmente da un feto all’altro, a seconda della natura dell’asfissia, della sua gravità e della capacità del cuore di far fronte all’emergenza con le proprie riserve (19). Nel periodo perinatale, la riduzione dell’apporto di ossigeno a livello del tessuto nervoso provoca l’encefalopatia ipossico-ischemica. L’ischemia è legata alla diminuzione della perfusione cerebrale.
Meccanismo delle lesioni cerebrali
Intervengono 3 fenomeni:
*Basato su: Fourniè A, Connan L, Parant O, Lesourd-Pontannier F. Sofferenza fetale acuta. Encycl Mèd Chir (Editions Scientifiques et Mèdicales Elsevier SAS, Paris), Ginecologia-Ostetricia, 5-077-A-30, 2000, 15 p.
2.4 Asfissia e paralisi cerebrale
Solo una prolungata o grave ipossia può causare un danno cerebrale con esiti di disfunzione sia motoria che intellettiva. Il neonato a termine di gravidanza che abbia subito in grado elevato si ipossia mostrerà segni e sintomi di disfunzione neurologica nell’immediato periodo post-natale. Approssimativamente 1/3 dei bambini che abbiano subito una ipossia grave, muore. I bambini che sopravvivono ad un’ipossia così grave da causare un danno cerebrale permanente, mostrano indici di Apgar bassi persistenti a 10-15 min dalla nascita. Appare evidente la disfunzione cerebrale ipossica nei neonati che presentano ipotonia, assenza della suzione, riflessi neurologici diminuiti o assenti: tale patologia viene definita "encefalopatia ipossico-ischemica" La gravità e la persistenza temporale di questi sintomi sono correlati con gli esiti. Le convulsioni nel periodo neonatale precoce, durante le prime 36 ore di vita, associate con questi sintomi, sono gli indicatori principali per la predittività di esiti neurologici sfavorevoli.
La paralisi cerebrale del neonato di basso peso o nel neonato prematuro è più frequentemente correlata alla leucomalacia periventricolare o all’emorragia periventricolare / intraventricolare.
La paralisi cerebrale, come esito di una grave ipossia, si presenta comunemente come una quadriplegia spastica associata a grave ritardo mentale. L'eziologia della maggior parte di altre forme di paralisi cerebrale non è ancora completamente conosciuta, è presumibilmente è secondaria ad alterazioni dello sviluppo cerebrale. L’introduzione delle moderne tecniche di neuro-radiologia ha permesso negli ultimi anni di stabilire che lesioni silenti periventricolari dell’inizio del terzo trimestre di gravidanza e lesioni corticali / sottocorticali del tardo terzo trimestre giocano il maggior ruolo nella genesi della patologia.
Il miglioramento della sorveglianza ostetrica e delle cure neonatali ha determinato negli ultimi 50 anni una progressiva riduzione dei tassi di mortalità perinatale, soprattutto per i nati pretermine e di basso peso. In particolare si è registrato un aumento della sopravvivenza dei neonati di peso inferiore a 1500 g del 15-40% negli anni ’70, del 60-75% nella metà degli anni ’80 e tali percentuali sono in continuo miglioramento (20).
Ciononostante la paralisi cerebrale è la principale forma di disabilità neuromotoria nell’infanzia la cui prevalenza generale si attesta da decenni fra l’1,5 ed il 3 x 1000 nati vivi. L’evoluzione nelle cure pre-natali e neonatali non ha prodotto sostanziali cambiamenti nella comparsa di tale patologia nei neonati a termine di peso > 2500 g, la cui prevalenza media si aggira sull’1-1,5 x 1000 nati, a seconda delle casistiche, con una origine spesso antepartale, solo più raramente post natale o asfittica (0,5 x 1000) (21).
2.5 Correlazione Apgar-Asfissia
Il punteggio di Apgar fornisce informazioni sull’adattamento del neonato alla vita extra-uterina, ha il merito di valutare in modo semplice le condizioni del bambino alla nascita.
I parametri principali (autonomia respiratoria, ritmo cardiaco, colorito cutaneo), fungono da indici per ricorrere all’eventuale rianimazione in sala travaglio: la valutazione contemporanea del punteggio da attribuire ai suddetti parametri va fatta a 1 e a 5 min. dalla nascita.
Vi sono tre risultati fondamentali in base al punteggio ottenuto:
L’evoluzione del punteggio è importante. Se a 5 min. il punteggio non raggiunge il valore 8 vanno effettuate altre valutazioni a 10, 15 e 20 min. fino al raggiungimento del valore 8.
Poichè la patologia ipossico-ischemica è causa di basso valore di Apgar e poiché questo è influenzato da una eventuale patologia ipossico-ischemica in atto, si fece strada l’ipotesi che l’indice di Apgar potesse essere la base per comparare le condizioni cliniche alla nascita con il successivo sviluppo mentale e motorio. L’Apgar score fu considerato indicatore della condizione di asfissia perinatale e di esiti neurologici a distanza, attribuendogli un significato prognostico che Virginia Apgar non aveva certo inteso attribuirgli.
Negli ultimi 15 anni molti studi hanno evidenziato le molteplici limitazioni di questo approccio.
I dati ancora oggi maggiormente significativi provengono dall’analisi "Apgar Scores As Predictors Of Chronic Neurologic Disability" che Nelson, neurologo pediatra ed Ellemberg, epidemiologo e biostatistico, condussero sui risultati del "National Collaborative Perinatal Project", un’indagine multicentrica iniziata nel 1959 che seguì circa 54000 donne durante la gravidanza e studiò i loro figli con un follow up fino a 7 anni di età (22).
Nelson ed Ellemberg studiarono una coorte di circa 49000 bambini, focalizzando l’attenzione, sui valori di Apgar score in bambini con e senza paralisi cerebrale a 7 anni, il valore predittivo dell’ Apgar per morte o paralisi cerebrale, la durata di Apgar score molti basso e l’outcome dei neonati con valori di Apgar prolungatamente molto bassi che sopravvissero.
L’analisi fu portata avanti distinguendo l’outcome in relazione al peso alla nascita (maggiore o minore di 2500 g). Si riuscì ad ottenere un follow up a 7 anni per 37000 bambini. I risultati confermarono parzialmente il concetto generale che un basso punteggio di Apgar ad 1 e 5 min. era associato ad un aumentato rischio di morte o paralisi cerebrale e che un Apgar che persisteva molto basso a 10, 15 e 20 min. era predittivo di un outcome neurologico sfavorevole. Ma non esisteva un rapporto diretto tra queste condizioni.
Nel gruppo di bambini senza paralisi cerebrale, il 5% aveva un Apgar score a 1 min. compreso tra 0 e 3, il 14% aveva un punteggio tra 4 e 6, mentre a 5 min., l’1% aveva un punteggio Apgar fra 0 e 3 ed il 3% fra 4 e 6.
Quindi un Apgar score molto basso, anche a 5 min. non è assolutamente predittivo di paralisi cerebrale.
Esaminando il gruppo di 120 bambini con paralisi cerebrale si notò che, sebbene si riscontrasse con più frequenza un indice di Apgar basso, particolarmente nel range 0-3 rispetto ai bambini normali e che tale differenza era più marcata a 5 min. rispetto a1 min., pur tuttavia, la metà dei bambini con paralisi cerebrale aveva un Apgar score tra 7 e 10 a 1 min. ed almeno 3/4 avevano uno score entro valori normali a 5min.
In conclusione, la correlazione dell'indice di Apgar con il futuro outcome neurologico, aumenta quando il punteggio rimane molto basso, tra 0 e 3 a 10, 15 e 20 minuti, ma questo non indica la causa della futura disabilitá: un basso valore di Apgar, da solo, non puó significare che la causa della paralisi cerebrale é l'asfissia.
Per tali ragioni, nel 1966, il Committee on Obstetric Pratice of the American College of Obstetricians and Gynecologists, in concerto con l'American Academy of Pediatrics Committee of Fetus and Newborn, ha pubblicato una revisione dal titolo "Use and Abuse of the Apgar score" nello sforzo di enfatizzare i limiti dell'indice di Apgar nell'identificare il neonato asfittico e di predirne l'outcome neurologico.
Secondo questo lavoro, un neonato con asfissia intrapartum, tanto grave da provocare un danno ipossico ischemico cerebrale, dovrebbe presentare tutte queste caratteristiche :
· Marcata acidosi metabolica o mista (pH < 7) in un campione di sangue dell'arteria ombelicale.
· Apgar score tra 0 e 3 per piú di 5 minuti
· Manifestazioni neurologiche neonataali (ipotonia, convulsioni, coma).
· Compromissione pluriviscerale, cardiovascolare, gastrointestinale, ematologica, polmonare, renale.
Quindi un basso Apgar score a 5 minuti, che persiste basso a 15-20 minuti, secondo i criteri dall'American Academy of Pediatrics, non é da solo tra i segni piú fortemente indicativi di successiva encefalopatia ipossico-ischemica. Al contrario, il miglioramento del punteggio di Apgar da 0 a 20 minuti é universalmente considerato ed accettato come il dato piú diretto per indicare e valutare il successo delle manovre rianimatorie.
Una stretta e diretta corrispondenza esiste invece tra indice di Apgar molto basso (tra 0 e 3) a 10, 15 e 20 minuti e mortalitá neonatale, in paricolare per i nati di peso molto basso (tab II palla pag 326 )
I dati del National Collaborative Perinatal Project, mostrarono che, di tutti i 390 neonati con punteggio Apgar inferiore o uguale a 3 a 20 minuti, solo il 31% sopravvisse fino al 7° anno di vita.
La mortalitá fu straordinariamente elevata (95.7%) nel sottogruppo di neonati di basso peso ed in ogni modo notevole (59%) anche nel sottogruppo di nati a termine. Uno studio successivo condotto da Casey, dal 1988 al 1998, confermó che un Apgar score compreso tra 0 e 3 a 5 minuti, rimane un efficace indice di mortalitá sia nel neonato a termine che nel pretermine (23).
2.6 Monitoraggio elettronico fetale (EFM) e asfissia perinatale
Il monitoraggio ostetrico riduce la mortalitá perinatale dovuta ad ipossia fetale (24), permette di individuare un inizio di ipossia e dovrebbe, quindi, aiutare a prevenire la comparsa dell'ipossia grave.
Questo calo della mortalitá perinatale spinge a porsi il problema della morbilitá e quindi a ricercare in clinica umana, nel monitoraggio durante il travaglio, elementi correlati alla sindrome ipossico-ischemica o all'encefalopatia ipossica e alla comparsa di postumi neurologici.
Purtroppo gli studi che hanno affrontato questo argomento sono troppo pochi .
Uno di essi (25) ha riscontrato una buona correlazione tra le decelerazioni tardive durante la dilatazione e/o le bradicardie durante l'espulsione e la comparsa di una sindrome ipossico-ischemica.
Purtroppo le alterazioni del ritmo cardiaco fetale non sono sempre cosí caratteristiche e anomalie meno importanti devono essere sottoposte ad una interpretazione piú delicata, in quanto, sono difficili da quantificare per consentire analisi statistiche .
Dai dati fino ad oggi disponibili risulta che il 10% circa delle paralisi cerebrale (PC) sarebbe dovuto al parto (26,27 28 29 30,31).
Questa percentuale é stata ottenuta senza prendere in considerazione non solo tutte le altre cause (ad es. genetiche, infettive, ambientali, etc..) ma anche altri fattori predisponenti che, da soli, non avrebbero forse causato l'handicap, ma i cui effetti sono stati aggravati dalle condizioni del parto.
Un attacco ipossico, sia pur minimo, associato a disturbi cronici, potrebbe favorire l'insorgere della PC. I lavori di Meyrs (32) confermano questa ipotesi.
L'intreccio tra asfissia perinatale e patologia prenatale é stato confermato anche in altri studi (33,24).
Probabilmente ad alcuni ostetrici é capitato di avere una
paziente nella quale, il monitoraggio fetale, registrando un episodio riconosciuto come da probabile asfissia, é stato seguito dalla nascita di un bambino molto malato a cui hanno diagnosticato in seguito una PC.D'altra parte viene spontaneo chiedersi come sia possibile che molte
pazienti, pur presentando un andamento del monitoraggio fetale ugualmente infausto, partoriscano invece neonati che si sviluppano normalmente.Le variazioni del tracciato, considerate patologiche non sono secondarie solo all’ipossia fetale, come considerato in passato, ma secondarie anche all’influenza del sistema nervoso simpatico e parasimpatico e a quella delle catecolamine materne che attraversano la placenta. Pertanto questo spiega come tracciati francamente patologici esistano in neonati perfettamente sani e tracciati normali esistano in neonati con indice di Apgar basso.
Il monitoraggio fetale elettronico poterebbe non essere in grado di identificare l'asfissia con sufficiente accuratezza, tale da mostrare una relazione con la PC .
In uno studio condotto a Oxford neppure un bambino con PC ha mostrato di aver avuto una reazione a prova dell'asfissia fetale nel tracciato del monitoraggio fetale (34).
Sembra, quindi, che sia frequentemente sbagliata la credenza che interrompere il quadro anomalo dell’ EFM permetta di evitare la lesione cerebrale, oppure che la lesione cerebrale si manifesti comunque. Considerando quest’ultima spiegazione, si ammette la possibilità che un tracciato EFM anomalo, l’asfissia fetale, o entrambi, siano semplicemente la prima prova disponibile della lesione cerebrale fetale, non la sua causa. Infatti le cause del danno cerebrale non sono soltanto l’ipossia ma vi sono anche le cause genetiche, virali, tossine batteriche, metalli pesanti, pesticidi, irradiazione e altro, che possono esercitare il loro danno, anche in epoca molto precoce della vita embrionale e fetale quando il cervello presenta ancora la matrice cerebrale da cui, per migrazione, si formano i vari organi cerebrali.
Numerosi studi relativi all’ osservazione di diversi quadri di EFM associati ad anomalie congenite e a "sofferenza fetale cronica"(35,36,37,38,39,40,41) sono giunti alla conclusione che sia abbastanza improbabile che certi tracciati EFM possano predire la lesione cerebrale e che un feto cerebroleso possa presentare acidosi e avere un quadro EFM che suggerisca tale situazione come prima manifestazione della lesione.
Sicuramente, non bisogna più ritenere che il danno a livello cerebrale debba sempre essere il risultato e mai la causa dei gravi casi di asfissia perinatale.
BIBLIOGRAFIA
CAPITOLO 4
Asfissia perinatale e danni cerebrali minori *
Gli studi di laboratorio descritti nel capitolo 2 sembrano indicare che esista una soglia individuale per il danno cerebrale e la sopravvivenza.
Secondo questa "teoria di soglia" una ischemia-ipossia minore può essere tollerata per periodi prolungati senza produrre nessuna evidenza di danno cerebrale irreversibile, mentre una ischemia-ipossia maggiore porta rapidamente a morte.
Come stadio intermedio, esiste una seconda soglia che delinea un’area critica di ipossia-ischemia subletale che è superata dagli animali, ma con danno cerebrale irreversibile.
Il danno cerebrale irreversibile si rivela clinicamente come encefalopatia neonatale seguita da paralisi cerebrale (con o senza ritardo mentale ed epilessia).
Molti autorevoli pediatri e neurologi pediatri appoggiano la "teoria di soglia"(1,2) e criticano il concetto di "continum di accidenti riproduttivi" come fu postulato da Pasmanick e Lilienfeld nel 1959 (3).
*
Basato su: Vandenbussche F.P.H.A. in: Studies on the clinical significance of fetal blood pH. Katholieke Universiteit Leuven, België 1999La nozione che i meccanismi responsabili della morte possano, in gradi meno severi, portare alla malattia, sembrano ovvi (4) e pertanto questa idea è stata ampiamente appoggiata e accettata da molti medici.
Accidenti riproduttivi non letali comprenderebbero, quindi, non solo la paralisi cerebrale o il grave ritardo mentale, ma anche disordini comportamentali, grado intellettivo minore di quanto atteso geneticamente, ritardo lieve dello sviluppo motorio e diverse forme di epilessia.
"I non addetti ai lavori" sembrano pensare che ogni rallentamento della frequenza cardiaca fetale ed ogni riduzione del punteggio di Apgar, causino cambiamenti permanenti nel cervello, anche se estremamente lievi, con una perdita concomitante di punti nello score della scala del quoziente di intelligenza.
Il concetto di minimo danno cerebrale o minima disfunzione cerebrale, formulato per la prima volta nel 1960, ha un grande fascino intrinseco.
La nascita è un evento vitale, drastico, complesso, e la gente si attende delle spiegazioni quando sussiste qualche imperfezione.
Per quello che riguarda l’asfissia da parto, è molto difficile dare una definizione ampiamente accettata, e ancora più difficile è trovare una relazione causale tra eventi perinatali e danno cerebrale grave nei singoli casi.
Per queste ragioni non dobbiamo attenderci una prova completa della esistenza o non esistenza di un rapporto causale tra gli eventi perinatali e "una disfunzione cerebrale minima".
In questo capitolo verrà esposto, a tal proposito, una review della letteratura inerente all’argomento.
Nel 1902, George Still presentò uno studio su Lancet, descrivendo venti bambini che erano aggressivi, disobbedienti, eccessivamente emozionali, con disturbi dell’attenzione e iperattività (5).
La condizione di iperattività, è stata già descritta dai greci antichi, nonostante, negli ultimi decenni c’è stato un continuo disaccordo su questo termine per quello che riguarda la definizione e l’eziologia.
Bradley, nel 1937, è stato forse il primo a proporre una terapia farmacalogica per l’iperattività (6) e molti psichiatri consigliano trattamenti con anfetamine, per esempio metilfenidate.
Nel 1960 la sindrome era definita come "disfunzione cerebrale minima", ma nel 1980 questa definizione è stata modificata in"disordini da deficit di attenzione" (DSM-III) e nel 1987 in "disordine iperattivo con deficit di attenzione"(ADHD) (DSM-III riv.) (7,8).
La definizione più recente di ADHD avviene nel 1994 con DSM-IV (9).
Gli aspetti principali della presente definizione sono: l’iperattività, la scarsa capacità di mantenere l’attenzione e lo scarso controllo dell’impulso (10).
I sintomi dovrebbero essere persistenti, causare notevole danno ed essere evidenti precocemente.
La prevalenza della ADHD è stata stimata intorno al 6% nei bambini, e circa tre volte più comune nei maschi rispetto alle femmine (10).
Due terzi dei bambini iperattivi, mantengono almeno un sintomo ADHD disabilitante nell’adolescenza (11). È stata notata anche una notevole associazione di malattie psichiatriche.
L’eziologia della ADHD e i meccanismi cerebrali attraverso cui i sintomi sono mediati, restano sconosciuti.
Tuttavia studi sui gemelli hanno dimostrato che i fattori genetici sono importanti.
Goodman e Stevenson, ad esempio, studiarono 570 coppie di gemelli dell’età di 13 anni, e confrontarono misure di attenzione e di iperattività tra gemelli monozigoti e gemelli dizigoti dello stesso sesso (12).
Per tutte queste misure la relazione intraclasse era più elevata per i gemelli monozigoti.
Conclusero che l’effetto genetico era responsabile per circa il 50% della varianza spiegabile di iperattività e disattenzione.
Fattori ambientali erano responsabili dello 0 fino al 30% dei casi. Non trovarono correlazione tra avversità perinatali e iperattività più tardiva.
Nel loro studio le avversità perinatali erano riferite al peso alla nascita ≤ 2000g, al gemello con peso inferiore e a quello nato per ultimo (12).
Alcuni studi sui gemelli hanno anche suggerito che esiste un importante ruolo eziologico per geni singoli per l’espressione della ADHD e i comportamenti associati, pur rimanendo inspiegato il modo di trasmissione della sindrome (13,14).
Molti autori considerano che la ADHD debba essere vista come una variante genetica e non come un disturbo preciso (15).
L’opinione corrente riguardo al meccanismo patogenetico alla base dell’ADHD è che esiste una disfunzione delle aree striate subcorticali e prefrontali del cervello che sono implicate nella inibizione di risposte irrilevanti e di funzioni esecutive (16,17).
Alcuni studi di risonanza magnetica sembrano appoggiare questa opinione, ma devono essere ancora ripetuti prima di poter dare delle conclusioni definitive (10).
Se pur la maggior parte dei ricercatori sono d’accordo sull’esistenza di un fenomeno biologico che causa la sindrome, i fattori psicosociali possono modulare la sua manifestazione.
Naeye e Peters analizzarono i risultati dei test di intelligenza di Wechsler, di quasi 20.000 bambini di età di 7 anni nel Collaborative Perinatal Study (18).
Questo studio prospettico seguì un gruppo di bambini nati tra il 1945 e il 1966.
Molti fattori demografici, come lo stato socio-economico, l’età materna, l’ordine di nascita e il sesso dei bambini, dimostrarono una relazione altamente significativa con indici di quozienti di intelligenza bassi.
In più, molti fattori concomitanti alla gravidanza, sia materni che fetali, ad es. l’uso di alcool e tabacco, il parto prematuro o la gravidanza multipla, l’ipertensione materna, il ritardo di crescita fetale, erano significativamente correlati con valori bassi di quoziente di intelligenza.
Tra gli altri fattori intraparto, Naeye e Peters , considerarono anse di cordone intorno al collo, ampi infarti placentari, la presenza di meconio nel liquido amniotico, l’uso di ossitocina, parto post-termine oltre la 42o settimana di gestazione, parto podalico e Apgar score (18).
Gli autori affermano che sarebbe stato meglio utilizzare i valori di pH e i gas del sangue del cordone ombelicale per identificare l’ipossia intrapartum, ma tali dati non erano stati raccolti nel Collaborative Perinatal Trial che iniziò nel 1959 (18).
Altri ricercatori pensano tuttora che complicazioni perinatali possono avere un ruolo eziologico per la ADHD o altri deficit minori (19,20).
Sprich-Bchkminster et al. paragonavano gli antecedenti di 73 bambini affetti da ADHD con quelli di 26 bambini psichiatrici e 26 controlli normali (20).
Le complicanze perinatali venivano suddivise in complicanze durante la gravidanza, il parto e l’infanzia.
La complicanza più importante della gravidanza, elencate dagli autori, era l’uso eccessivo di alcol, droghe e tabacco, farmaci, ipertensione, infortuni e problemi emotivi.
I problemi del parto erano definiti come parto podalico, taglio cesareo o altre difficoltà.
I problemi dell’infanzia erano il peso alla nascita, o interventi chirurgici nel primo mese di vita.
L’autrice concluse che la gravidanza e il parto e le complicanze durante l’infanzia, possono essere parte di un meccanismo eziologico non genetico nella ADHD specialmente per bambini che hanno disordini associati.
James Low et al. hanno studiato lo sviluppo motorio e cognitivo a 12 mesi di età in 37 bambini, nati con una base tampone dell’arteria ombelicale < 34 mmol /l, e in 76 bambini senza evidenza di asfissia neonatale (19).
Sedici bambini del gruppo di studio avevano anche sofferto di encefalopatia neonatale.
L’incidenza di deficit maggiori era del 14% nel gruppo con asfissia e solo dell’1 % nel gruppo di controllo (19).
L’incidenza di difetti minori era del 27% nel gruppo con asfissia e solo del 6% nel gruppo di controllo (19).
In uno studio precedente, tuttavia, gli autori hanno trovato lievi anomalie motorie nel 21% dei bambini del gruppo di controllo (21).
Nel commento affermano che, i concetti della "soglia" oltre la quale avviene il danno e il conseguente continum di danni, sono complementari, ritenendo che, sicuramente esiste un certo grado di asfissia intrapartum il quale è tollerato senza evidenza di effetto sulle funzioni motorie e cognitive.
Oltre questo punto, tuttavia, loro intravedono uno spettro di deficit maggiori e minori.
Non esiste pertanto, al momento attuale, una evidenza sicura per queste teorie, sia sulla causa della varietà di deficit minori che sulla frequenza della loro insorgenza e sull’esistenza dei meccanismi compensatori.
In conclusione, la maggior parte delle evidenze è a favore della cosiddetta teoria della soglia, la quale implica che la asfissia perinatale, che non conduce a morte, porta, nella maggioranza dei casi ad un recupero completo.
Così come nella asfissia dell’adulto, vi una sottile area critica fra morte e sopravvivenza in cui gli individui, nella maggior parte dei casi, possono sopravvivere con danni cerebrali maggiori.
Non esiste evidenza che difetti minori possano avvenire come conseguenza di eventi perinatali.
Esiste, invece, una chiara evidenza che influenze ambientali durante la vita fetale per esempio il fumo materno, hanno un’ influenza negativa sul cervello fetale ed aumentano la probabilità di difetti di sviluppo minori.
In assenza di encefalopatia neonatale moderata o severa, d'altronde, non vi è motivo di credere che segni anche gravi di asfissia perinatale possono avere una influenza negativa sullo sviluppo del bambino.
BIBLIOGRAFIA
Capitolo 5
valutazione dell’outcome neonatale sfavorevole a lungo termine*
Introduzione
L’asfissia perinatale definita dal punto di vista clinico o biochimico, può insorgere prima, durante o dopo il parto e può essere seguito dalla morte, dal recupero completo o da un recupero con difetti residui.
Quest’ultimo può riaffiorare dopo un periodo di recupero completo apparente, nel quale, sono stati tuttavia inibiti i normali processi di maturazione.
Segni che possono essere in rapporto con l’asfissia perinatale, come la bradicardia fetale o l’Apgar basso, succedono abbastanza frequentemente.
L’incertezza sulla relazione (causale o meno) fra questi segni, ed uno sviluppo cerebrale compromesso, è fonte di preoccupazione sia per la popolazione generale che per i clinici.
Diversi studi hanno riportato una associazione tra indicatori postnatali di asfissia perinatale e un conseguente outcome sfavorevole.
La severità della asfissia perinatale in questi studi è stata indicata sia con sistemi di conteggio clinico, come l’Apgar e il punteggio Sarnat (1,2), o con misure biochimiche, quali, il pH del sangue del cordone.(3)
La maggior parte di questi studi hanno una definizione di outcome sfavorevole o della morte neonatale o della paralisi cerebrale.
Nel presente studio sono stati utilizzati i principi della metanalisi classica per analizzare e sintetizzare associazioni quantitative tra asfissia perinatale ed un outcome sfavorevole grave essenzialmente per due scopi:
*Basato su: Vandenbussche F.P.H.A. in: Studies on the clinical significance of fetal blood pH. Katholieke Universiteit Leuven, België 1999
Metodi
Gli autori hanno eseguito una ricerca della letteratura dal 1966 al settembre 1997 per cercare studi che esaminano l’associazione tra punteggi di valutazione del neonato e outcome sfavorevole a lungo termine .
Il DIMDI (Isituto tedesco per le informazioni e documenti medici) è stato utilizzato per ricercare 20 Database medici comuni, compresa Medline, sulla associazione tra punteggio di Apgar e pH del cordone ombelicale e outcome sfavorevole a lungo termine.
Abbiamo cercato le seguenti parole chiave da sole o in combinazione: Apgar score, sangue del cordone ombelicale, pH del sangue, equilibrio acido-base, neonato, neonatale, morte, paralisi cerebrale.
Il Medline è stato utilizzato per ricercare la associazione tra encefalopatia neonatale e outcome sfavorevole a lungo termine.
Nell’ultima ricerca sono stati utilizzati l’encefalopatia neonatale, Sarnat e handicap neurologico come parole di testo e mortalità infantile, paralisi cerebrale, ritardo mentale, disabilità di sviluppo e danno cerebrale come parole chiave.
Dagli abstract ricercati in questa maniera sono stati studiati i lavori e la relativa bibliografia utilizzabili.
Gli Autori hanno selezionato solo quei lavori che hanno studiato l’associazione appropriata e che hanno dato un numero di dati sufficienti per permettere una tabulazione di tabelle di contingenza.
Revman 3.Ob (Cochrane Review Manager, Cochrance Collaboration) è stato utilizzato per calcolare la odds ratio comune (o tipica) per ogni associazione.
Le odds ratios e l’intervallo di confidenza (95% CI) sono stati calcolati usando il modello di effetto random, perché le differenze in odds ratio erano probabilmente basate sulla coincidenza, così come sulla differenza tra popolazioni di studio.
La dimensione di ogni studio è stata presa in considerazione per la valutazione della odds ratio comune.
Risultati
La ricerca in letteratura è risultata in 1312 abstract.
Gli autori hanno letto 281 lavori, 213 derivati dalla ricerca e 68 trovati tra le indicazioni bibliografiche di questi lavori.
Di questi 281 studi, 81 diedero abbastanza dati per costruire delle tavole di contingenza.
Trentanove di questi 81 studi, sono stati successivamente esclusi perché riportavano su pazienti che erano già stati inclusi nelle meta-analisi o perché usavano livelli di cut-off o definizioni di outcome che differivano da quelli della maggior parte degli altri studi.
Nei rimanenti 42 studi gli Apgar Score sono stati classificati in tre gruppi (0-3, 4-6, e 7-10) (1).
Gli autori hanno utilizzato il punteggio di Sarnat per la encefalopatia (0, I, II, III )(2).
Le misurazioni del pH dell’arteria ombelicale sono state classificate con intervalli di 0.1 tra 7.0 e 7.2.
Le meta-analisi per la previsione di morte neonatale, erano basate su tipi differenti di studi osservazionali: otto studi di coorte di parto(4,11), e ventisette studi di follow-up di bambini selezionati (2,12,37).
La mortalità neonatale negli otto studi di parto era dell’1.4% (4,11).
Le meta-analisi per la previsione delle paralisi cerebrali erano basate su uno studio di coorte alla nascita (10), sette follow-up selettivi
( 15,16,21,29,31,38,39) e due studi caso- controllo (40,41).
La frequenza della paralisi cerebrale nei sopravvissuti negli studi di coorte alla nascita era di 0.3 % (10).
Negli studi di coorte alla nascita, punteggio di Apgar molto bassi (0-3) e bassi (4-6) sono stati dati rispettivamente a 5.2 % e a 11.3 % dei bambini dopo 1 minuto( 4,6,7,10,11), 0.9 e 1.7% dopo 5 minuti (5,6,8,10), 0.7 e 1.2% dopo 10 minuti (10), e 0.3 % e 0.4 % dopo 20 minuti (10).
I punteggi di Apgar a 10 e 20 minuti erano validi per rispettivamente 11.6% e 44 % dei neonati della presente analisi (10).
Goldaber et al. trovarono valori di pH nell’arteria molto bassi ( < 7) e bassi (7.0-7.1) nello 0.3 % e 1.3 % dei neonati (12).
Thornberg et al. trovarono l’ encefalopatia neonatale nello 0.5 % (Sarnat grado III ),
0.4 % (Sarnat grado II) e 0.9 % (Sarnat grado I ) dei neonati, mentre il 98.2 % non mostravano alcun segno di encefalopatia neonatale (Sarnat grado 0) (13).
Previsione di morte neonatale
La tabella I elenca le odds ratios comuni per l’associazione tra punteggio di valutazione neonatale e morte neonatale.(2,4,37)
La figura 1 illustra come è stata ottenuta una comune odds ratio. In questo esempio, la comune odds ratio per la morte neonatale che confronta Sarnat grado III verso Sarnat grado II è derivata da 12 studi con odds ratios che vanno da 5.0 a 130.3, tutti con un ampio intervallo di confidenza al 95 % (2, 13, 22, 29,31, 37).
La comune odds ratio in questo esempio è 23.7 (CI 95 % : da 13 fino a 45 ) ciò implica che la probabilità di morte neonatale è 24 volte maggiore per un bambino affetto da encefalopatia con Sarnat grado III, che per un bambino con encefalopatia Sarnat grado II.
Dai dati nella Tab.I si può dedurre che, la probabilità di morte neonatale per i bambini con Sarnat grado III, era 171 volte quella dei bambini con Sarnat grado I (odds ratio Sarnat III verso Sarnat II moltiplicato per odds ratio Sarnat II verso Sarnat I, ossia 23.7 × 7.2 = 171 )
Mentre alcuni studi hanno permesso di stratificare gruppi di bambini secondo il loro peso alla nascita, le odds ratios derivate in questa maniera risultarono in un modello non consistente.
Per esempio, nello studio di Nelson ed Ellenberg, (10) la probabilità per morte con punteggio di Apgar bassi a 1 e a 5 minuti aumentava con la diminuzione del peso alla nascita, mentre negli studi di Ikomen e Lauslathi queste probabilità diminuivano con la diminuzione del peso alla nascita.(34, 35)
Table I. Meta-analysis of associatons between newborn assessment scores and
neonatal death in birth cohort and selective follow-up studies
Newborn assessement Neonatal death/all live births Common OR 95% CI
Lower score higher score
|
1 min. Apgar score 2,4,6,7,11,31,360 – 3 versus 4 – 6 0 - 4 versus 7-10 |
833/5,462 379/11,744 |
379/11,744 600/85,587 |
5.7 7.1 |
5.0 – 6.5 4.0 – 12.8 |
|
5 min Apgar score 2,5,6,8-10,30-320 – 3 versus 4 – 6 4 – 6 versus 7 - 10 |
1,761/3,3354 939/6,510 |
939/6,510 2,113/370,785 |
5.7 20.4 |
4.2 – 7.9 10.8 – 38.6 |
|
10 min Apgar score 10, 30, 310 – 3 versus 4 – 6 4 – 6 versus 7 - 10 |
250/368 181/672 |
181/672 181/5,312 |
5.7 6.0 |
4.3 – 7.6 1.8 – 20.5 |
|
20 min Apgar score 100 – 3 versus 4 – 6 4 – 6 versus 7 - 10 |
156/178 95/233 |
95/233 91/1,950 |
10.3 14.1 |
6.1 – 17.3 10.1 – 19.7 |
|
Sarnat score 2,13, 22 –29,31,37III versus II II versus I |
124/184 17/270 |
19/306 0/366 |
23.7 7.2 |
12.5 – 44.9 2.0 – 25.5 |
|
Umbilical artery pH 12, 14-21pH<7.10 versus pH> 7.10 pH<7.20 versus pH>7.20 pH<7.00 versus pH 7.00-7.10 pH<7.00 versus pH 7.00-7.20 |
44/595 36/145 7/87 7/87 |
130/4,722 42/756 1/385 7/3,412 |
7.6 4.9 33.6 42.6 |
3.3 – 17.5 2.2 – 10.8 4.1 – 278.0 14.6 – 124.2 |
OR: Odds Ratio
CI: Confidence Interval
Figura 1. Rappresentazione grafica delle odds ratios (OR) e loro intervalli di confidenza 95 % (95 % CI) di 11 studi sulla associazione tra morte neonatale e punteggio Sarnat di encefalopatia (2,12,21,29)
La comune odds ratio (o tipica) era stato calcolato usando Revman 3.Ob (CochraneReview Manager,Cochrane Collaboration)
n = numero di neonati morti
N =totale del numero dei nati vivi
Previsioni di paralisi cerebrale o di altre disabilità neurologiche.
La tabella II elenca le comuni odds ratio per l’associazione tra punteggi di valutazione neonatale e paralisi cerebrale. (10,15,16,21,29,31,38,41)
Le comuni odds ratios per il pH dell’arteria ombelicale e la paralisi cerebrale sono stati derivati da sei studi tutti comprendenti bambini nati pretermine o con peso basso alla nascita.(15,16,21,39,41)
Come si vede nella tabella II, le comuni odds ratios avevano valori intorno al 2 (1.6 fino a 2.5) e solo la differenza tra pH < 7.10 verso il pH ≥ 7.10 raggiungeva un valore statisticamente significativo.
Table III. Meta-analysis of associations between Sarnat scores and neurologic disabilities with mental retardation in surviving children in six selective follow-up studies.
Newborn assessment Disabilities/all survivors Commor OR 95% CI
lower score higher score
Sarnat score
13, 22-24,37,42III versus II 18/23 56/174 4.6 1.5 – 13.9
II versus I 45/159 1/212 27,4 7.8 – 95.6
I versus 0 0/36 3/149 0.6 0 – 11.4
OR: Odds Ratio
CI: Confidence Interval
Sei studi esaminarono la associazione tra encefalopatia neonatale e disabilità neurologiche accompagnate da ritardo mentale (13,22,24,37,42).
La tab.III elenca le comuni odds ratio per queste associazioni.
Le disabilità neurologiche a lungo termine sono state riscontrate nell’84 % dei sopravissuti con Sarnat grado III, nel 30 % dei sopravissuti con Sarnat grado II e in meno del 5 % dei bimbi con Sarnat grado 0 o 1.
Due studi cercavano la associazione tra pH della vena ombelicale e disabilità neurologiche (43-44).
Huisjis et al. trovarono una odds ratio di 8.2 (CI 95 % : 4 fino a 15) quando comparavano la frequenza di disabilità neurologiche in bambini con pH della vena ombelicale bassa ( ≤ 7.10) verso un pH alto (7.11, 7.20) (44).
Commento
Mentre numerosi studi si indirizzano verso la valutazione neonatale ed un outcome sfavorevole grave, solo un numero limitato di studi danno dati sufficienti per costruire tabelle di contingenza.
Otto studi diedero dati su grandi coorte di bambini (4,11), gli altri studi diedero dati su gruppi molto più ristretti (2,12,44).
Una critica ragionevole su studi come il presente, è che i dati sono accumulati in un lungo periodo di tempo, durante il quale, l’outcome neonatale è migliorato considerevolmente.
Per esempio, la mortalità neonatale media di 1.4 % nei dati dati complessivi (4,11), è di tre fino a quattro volte più alta che la mortalità neonatale osservata nella pratica corrente.
Nella figura 1 sono illustrati i dati ottenuti in un periodo di 20 anni che dimostravano odds ratio individuali con una variazione che è visibile, indipendentemente dall’anno di pubblicazione.
D’altra parte la frequenza della paralisi cerebrale nei sopravissuti nell’analisi complessiva era di 0.4 % (10), e questo è equivalente alla frequenza in studi più recenti (45,51).
Sono stati eseguiti un numero di studi di follow-up su bambini con un pH basso o con basi tampone bassi alla nascita, ma soltanto alcuni includevano dati su bambini di controllo (52,57).
Sembra, da questi studi, che la paralisi cerebrale rappresenti una evenienza raramente associata con il pH del sangue ombelicale basso alla nascita.
Pertanto, sarebbero necessari degli studi ampi di caso- controllo per documentare la esistenza di questa associazione tra pH del sangue ombelicale basso e paralisi cerebrale.
In questa mata-analisi, soltanto la encefalopatia neonatale grave (Sarnat grado III ) è fortemente predittiva di un outcome sfavorevole grave.
Gli altri indicatori neonatali indicano predominantemente un aumento relativo o diminuzione della probabilità di un outcome a lungo termine sfavorevole.
Per esempio, punteggi di Apgar molto bassi (0-3) ad 1 minuto, erano associati ad una mortalità neonatale del 15 % , sei volte superiore se comparati con valori di Apgar bassi ( 4-6 ) e quaranta volte più elevati se comparati con punteggi di Apgar elevati (7-10).
Valori di pH dell’arteria ombelicale molto bassi ( <7 ) erano associati con l’8 % di mortalità neonatale, una frequenza 43 volte superiore di quella con un pH dell’arteria ombelicale ≥ 7.
Il punto di cut-off più importante nella previsione della morte neonatale erano punteggi di Apgar bassi (4-6 ) verso punteggi alti (7-10) dopo 5 e dopo 20 minuti, encefalopatia di grado III verso grado II e un pH dell’arteria ombelicale < 7 verso un pH ≥ 7.
Una comune odds ratio di morte neonatale indicava una netta differenza statistica per tutti i confronti tra punteggi bassi e punteggi alti (tabella I ).
Associazioni di punteggi per la valutazione neonatale sfavorevole e paralisi cerebrale erano molto più deboli che per la morte neonatale.
Solo punteggi di Apgar bassi a 20 min ed encefalopatia grave neonatale ( Sarnat grado III ) erano altamente predittivi di paralisi cerebrale nei sopravissuti.
Punteggi di Apgar molto bassi (0-3) ad 1 min erano associati a paralisi cerebrale nell’ 1.7 % dei sopravissuti ; una frequenza quattro volte superiore rispetto a punteggi di Apgar ad 1 min elevati (7-10).
Una comune odds ratio per l’associazione tra il pH dell’arteria ombelicale e la paralisi cerebrale, erano approssimativamente due. Tuttavia queste probabilità erano basate solamente su sei studi, tutti, in bambini prematuri o con basso peso e la maggior parte degli intervalli di confidenza comprendevano l’unità.
L’encefalopatia di Sarnat grado II era asoociata con disabilità neurologica a lungo termine nel 30 % dei sopravissuti (tabella III ).
In conclusione, i punteggi di valutazione neonatale, sono strumenti clinici ragionevoli per la selezione di bambini a rischio di outcome sfavorevole grave a lungo termine.
I diversi sistemi di valutazione danno le loro individuali informazioni, ma è chiaro che non si può affermare che queste siano indipendenti tra di loro.
La encefalopatia severa (Sarnat grado III ) era presente nello 0.5 % dei neonati ed era fortemente predittiva di un outcome sfavorevole a lungo termine.
Punteggi di Apgar molto bassi (0-3 ) a 20 minuti erano ottenuti nello 0.3 % dei neonati; l’ 88 % di questi bambini morirono e nei sopravissuti il 41 % svilupparono la paralisi cerebrale. Mentre punteggi di Apgar molto bassi (0-3) o bassi (4-6 ) a 1 e 5 minuti, così come valori di pH dell’arteria ombelicale molto bassi < 7, erano associati con un aumento di 5 volte della probabilità di morte.
Invece la associazione con la paralisi cerebrale era meno evidente
Meno del 5 % dei sopravissuti con un punteggio di Apgar molto basso (0-3) a 5 min e meno del 2 % di questi con un punteggio di Apgar molto basso a 1 min, alla fine svilupparono la paralisi cerebrale.
Le associazioni non implicano necessariamente rapporti causali.
Il pH del sangue ombelicale, i punteggi di Apgar e il grading di Sarnat, riflettono soltanto la condizione dei neonati che è influenzata da fattori genetici prenatali e perinatali.
Un punteggio di valutazione neonatale sfavorevole non indica necessariamente un outcome sfavorevole, né indica la causa del risultato scarso di valutazione.
Cionostante la associazione tra punteggi di valutazione neonatale e gli outcome avversi a lungo termine, sono importanti.
Questi punteggi possono giocare un ruolo determinante nel caso in cui bisogna decidere se interrompere l’assistenza neonatale.
Questi punteggi sono anche utili per fornire un counseling realistico ai genitori e prevenire un pessimismo ingiustificato che può causare stress emotivo e può interferire con il rapporto figlio genitore.
Inoltre la forza relativa delle associazioni serve a comprendere i valori prognostici dei diversi sistemi di punteggio.
Pertanto, questa review sistematica di dati può allargare la base epidemiologica per studi ulteriori sul rapporto tra fattori perinatali ed outcome sfavorevole a lungo termine.
BIBLIOGRAFIA
Capitolo 6
Il valore della misura routinaria del pH del cordone
ombelicale alla nascita *
Introduzione
Nel 1916 Arvo Ylppö notò che i bambini erano più soggetti all’acidemia alla nascita che più tardivamente nella vita. Egli misurò il pH nel sangue dei bambini in fin di vita riscontrando un’improvviso calo del pH poco prima della morte. (1)
Più tardi nel 1960 Erich Saling pubblicò i primi risultati del pH del sangue fetale durante la nascita. ( 2)
Da allora, la misurazione del pH del sangue fetale divenne uno dei metodi più affidabili per verificare una compromissione dello stato fetale durante il parto.
Tale metodica è ampiamente usata per guidare gli interventi ostetrici quando sussiste un dubbio sul benessere fetale durante il travaglio.
Il pH del sangue fetale può essere misurato anche meno invasivamente alla nascita. Tuttavia il risultato raramente incide sul trattamento clinico e pertanto gli ostetrici non sono concordi sull’utilità di questa metodica. Per es., un indagine fra le cliniche universitarie ostetriche degli Stati Uniti, rivelava che il pH sul sangue del cordone alla nascita è misurato routinariamente solo nei 27% dei parti ( 3).
Nella presente review si riportano argomenti sia a favore che contro la misurazione routinaria del pH ematico del cordone alla nascita.
Verranno discussi il significato clinico dei valori normali e anormali, la affidabilità del metodo di questa misurazione, i fattori che la influenzano e i valori di cut-off del pH normale e anormale alla nascita.
*
Basato su: Vandenbussche FPHA, Oepkes D, Keirse MJNC. The merit of routine cord blood pH measurement at birth. J Perinatal Med 1999; 27(3): 158-65. Review
Campionamento e misura
campioni di sangue arterioso e venoso sono prelevati dal cordone ombelicale immediatamente dopo la nascita o dirittura prima del clampaggio e del taglio del cordone. Si raccomanda, però, di clampare il cordone prima, e di usare altri due clampaggi extra per isolare e utilizzare un segmento di cordone lungo fra i 10 e i 30 cm, da cui si potranno prelevare campioni anche più tardivamente.
Se si inizia il clampaggio sul lato del neonato, le arterie ombelicali possono in qualche maniera svuotarsi verso la placenta prima che venga fissata la seconda pinza, pertanto, è preferibile fissare la prima pinza dal lato placentare.
Il fatto di isolare una parte del cordone fra due pinze, offre diversi vantaggi.
Il sangue può essere prelevato dal cordone facilmente da un’altra persona; le misure possono essere ripetute se ci sono dei dubbi sul campione, per es. quando campioni di sangue arterioso e venoso danno valori di pH pressochè uguali.
Un punto ancora più importante è che il campionamento interferisce con minor probabilità con gli aspetti emozionali medici del parto, sia nella sala parto che nella sala operatoria.
Un segmento di cordone clampato può rimanere a temperatura ambiente per almeno 30 minuti senza influire, in nessun modo, sul campionamento e sulle misurazione (4,6). Quando si pospone la misurazione per più di 30 minuti è preferibile conservare i campioni nelle siringhe eparinate e tenerle nel giaccio (7,8).
La concentrazione di eparina (acida) in queste siringhe non dovrebbe eccedere le 50 UI/ml di sangue (9,10).
È importante fare un prelievo sia dell’arteria che della vena. Ciò permette di dimostrare, in modo convincente, che il pH arterioso è effettivamente stato eseguito su un’ arteria. Se si campiona solo un vaso si può facilmente arguire che il pH riflette il pH venoso, poiché, fare un prelievo dalla vena è normalmente più facile. (10,11) Ovviamente, un campionamento corretto, richiede anche una misurazione e una documentazione appropriata dei valori. È importante che vengano eseguite le istruzioni per l’utilizzo dell’apparecchio analizzatore sia per la calibrazione che per i controlli di qualità.
Al momento attuale molti analizzatori indicano se una certa misura è affidabile. Dovrebbero esistere, inoltre, delle adeguate procedure di sicurezza per evitare che risultati del pH cordonale siano erroneamente assegnati ad altri pazienti.
Interpretazione dei valori
Se i due valori di pH divergono sufficientemente, si può concludere che sono stati ottenuti campioni sia arteriosi che venosi. La differenza del valore fra i due campioni è piuttosto arbitraria. È ragionevolmente accettato, comunque, che il pH venoso dovrebbe eccedere il pH arterioso di almeno 0,03 unità per dare affidamento a questo risultato. Dati che non rispondono a questi criteri, sono sospetti e rappresentano soltanto il pH venoso.
Differenze fra misure ripetute di pH del sangue arterioso, ottenute dallo stesso cordone, sono state riportate in diversi studi. Queste differenze risultano da imprecisioni del pH analizzatore, da variazioni biologiche fra campioni e da variazioni nell’ottenere e trattare i campioni. Le deviazioni standard (DS) fra differenti campioni erano da 0,024 a 0,033 in studi che comparavano due misure eseguite immediatamente dopo la nascita (6,12) e di 0,024 fino a 0,045 in studi che comparavano misure fatte immediatamente e misure fatte con un certo ritardo ( 6,13). I limiti di confidenza al 95% per una singola misura di pH del sangue arterioso, sono pertanto, approssimativamente, il valore misurato ± 0,06, cioè, ± 2 deviazioni standard della differenza riportata ( 14).
Per la interpretazione clinica del pH dell’arteria ombelicale è necessario una riflessione su ciò che è normale o anormale.
Il pH del sangue fetale neonatale normalmente rimane abbastanza costante.
Durante la gravidanza il pH del sangue dell’arteria ombelicale ha un valore medio di 7.37 con un 95% di misure entro il range di 7.43 e 7.31
( 15).
Immediatamente dopo il parto, il valore medio di pH dell’arteria ombelicale è più basso, con un variabilità molto più vasta intorno alla mediana, dipendendo sia dalla modalità del parto e sia dalla variazione da persona a persona.
La durata e l’intensità dello stress fetale influenzerà questi valori.
Nel caso di morte fetale, il pH del compartimento extracellulare, compreso il sangue, eguaglia quello del compartimento intracellulare.
Il pH del sangue di un feto o di un neonato deceduto è usualmente intorno a 6.8 ed è sempre < 7. Questi valori bassi di pH in un feto vivo o neonato sono indicativi di asfissia.
Le tabelle I, II, III e IV, indicano i valori medi e i limiti inferiori, riportati in letteratura, dei valori statisticamente normali per il pH dell’arteria ombelicale.
La tabella I si riferisce a valori di donne con gravidanza normale e parto normale e con esclusione per es. delle pazienti che avevano un tracciato cardiaco fetale anormale ( 2,16,28). Il valore medio del pH del sangue dell’arteria ombelicale in questo gruppo variava fra 7.24 e 7.31, mentre i limiti inferiori della normalità statistica variavano tra 7.07 e 7.22.
La tabella II riassume pubblicazioni su popolazioni di interi ospedali (11.29.38). Questi risultati probabilmente riflettono la pratica ostetrica contemporanea in ospedali delle nazioni evolute. Maggiore è la preoccupazione per il "distress fetale" in un particolare ospedale, maggiore è la probabilità che questi feti saranno "tirati fuori" prima che subentri una ulteriore diminuzione del pH nel sangue. L’interpretazione di questi dati dipende dal fatto che molti libri di testo e, quindi, diversi ospedali, raccomandano di precipitare il parto se il campionamento del sangue fetale rivela un pH inferiore a 7.20. Questa raccomandazione è basata su studi di Saling nei primi anni ’60, il quale trovò che 7.2 era il limite inferiore statistico della distribuzione normale del sangue dello scalpo fetale durante il periodo dilatante in un travaglio non complicato
( 2).
Table I.
Arterial cord blood pH values after uncomplicated pregnancy and labor
Source: first author Number of births Mean arterial Lower statistical limit
(year of publication) examined cord blood pH of normal pH (mean-2 SD)
|
Saling (1964)2 Bretscher (1967)16 Padbury (1982)17 Yeomans (1985)18 Hankins (1987)19 Ruth (1988)20 Ramin (1989)21 Thorp (1989)22 Miller (1990)23 Romer (1991)24 Yancey (1992)25 Vintzileos (1992)26 Dudenhausen (1997)27 Diel (1998)28 |
77 100 91 146 110 106 1292 1694 147 2549 300 243 681 60 |
7.25 7.27 7.27 7.28 7.27 7.29 7.28 7.24 7.27 7.27 7.31 7.28 7.31 7.23 |
7.09 7.12 7.11 7.18 7.11 7.15 7.14 7.10 7.15 7.13 7.22 7.14 (10%<7.21) 7.07 |
Table II.
Arterial cord blood pH values in retrospective hospital based cohort studies U
Source: first author Number of births Mean arterial Mean arterial cord blood pH- 2 SD
(year of publication) examined cord blood pH (or other lower statistical limit)
|
Kubli (1972)29 Romer (1976)30 Sykes (1982)31 Josten (1987)32 Low (1988)33 Fee (1990)34 Perkins (1993)35 Goodlin (1994)36 Farkas (1995)37 * Westgate (1995)11 Westgren (1995)38 |
3 317 3 804 899 257 4 500 15 528 3 183 11 203 - 1 448 3 953 |
- 7.27 7.20 7.21 7.26 7.26 7.31 7.31 7.22 7.26 7.26 |
(5%<7.10) 7.10 7.04 7.06 7.13 - 7.15 7.18 7.05 (2,5%<7.05) 7.08 |
- Values not reported by the author
* This study included only validated cord blood pH values
U
Excluding Dutch units
Table III. Arterial cord blood pH values from Dutch obstetric deparments
Souce: first author Number of births Mean arterial Lower statistical limit of
(year of publication) examined cord blood pH normal pH (mean - 2 SD)
* Huisjes (1979)39 852 7.20 7.02
* Eskes (1983)40 4 667 7.23 7.09
Dyxhoorn (1986)41 2 220 7.21 7.00
Nagel (1995)42 1 614 7.21 7.03
* These studies included only validated cord blood pH values
La tabella III indica i risultati pubblicati di valori medi e limiti inferiori di pH del sangue dell’arteria ombelicale di reparti di ostetricia in Olanda dove molte donne, con gravidanze non complicate, partoriscono a casa piuttosto che all’ospedale ( 39,42). Questi studi pertanto includono un grande numero di donne con gravidanze e travaglio complicati.
Table IV. Arterial cord blood pH values after elective prelabor cesarean section
Source: first author Number of births Mean arterial Lower statistical limit of
(year of publication) examined cord blood pH normal pH (mean – 2 SD)
Boesel (1986) 43 - 7.26 7.16
Bader (1990) 44 54 7.29 -
Gregg (1991) 45 78 - 7.21
- Values not reported by the author
La tabella IV riassume i valori medi e i limiti inferiori del pH del sangue dell’arteria ombelicale dopo gravidanze normali esitate in taglio cesareo prima dell’inizio del travaglio ( 43,45).
Khoury et al. hanno dimostrato che il parto con taglio cesareo diminuisce il pH del sangue ombelicale di circa 0,05 unità (46). Nello studio hanno determinato valori del pH del sangue ombelicale immediatamente prima del taglio cesareo, eseguendo un prelievo di sangue dal cordone sotto guida ecografica e confrontando i risultati del pH del sangue della vena ombelicale misurati dopo il parto (46).
L’ampia letteratura riassunta nelle tabelle I, II, III e IV non ha portato ad un consenso unanime su quale sia il valore normale o anormale della misurazione del pH dell’arteria ombelicale alla nascita.
Molti autori hanno posto come cut-off , fra valore normale e anormale, livelli elevati poco realistici, variando fra 7,10 e 7,20 (36 47-49).
Un cut-off di anormalità dovrebbe essere sufficientemente sensibile (80 -90%) con un valore predittivo positivo, almeno del 5-10%, nell’individuare bambini che hanno contratto un danno asfittico, durante, piuttosto che prima o dopo il travaglio. Diversi studi indicano che valori di cut-off di 7 o 7.05 soddisfano queste esigenze (11,42,50,53). Tuttavia poiché l’intervallo di confidenza di una misurazione individuale del 95% è relativamente ampio (+006 fino a –006), l’uso di un valore di cut-off singolo non è realistico. Pertanto gli autori consigliano di classificare il pH del sangue dell’arteria ombelicale nelle seguenti 3 categorie:
In appoggio a questa classificazione esiste un’evidenza statistica e fisiologica. Dalla tabella I appare che il limite inferiore statistico per un pH del sangue dell’arteria ombelicale normale, si aggiri intorno a 7,11. In più Goeschen e altri hanno dimostrato che l’acidemia materna durante il parto, può contribuire sostanzialmente nel diminuire il pH fetale anche fino a 7.10 ed in meno dell’ 1% dei casi per valori < 7.10 (54). In nessuno dei casi in cui il pH era < 7.00, l’acidemia fetale poteva essere attribuita alla acidemia materna (54).
La variazione biologica del pH e, pertanto, intervalli di confidenza del 95% per misurazioni individuali di pH, sono considerevolmente più piccole nel sangue della vena ombelicale che nel sangue dell’arteria ombelicale (13 55). Pertanto l’utilizzo di una categoria borderline, nella interpretazione del pH del sangue della vena ombelicale, non dovrebbe essere necessario. Utilizzando gli stessi valori di cut-off arterioso per il pH venoso, risulta un aumento della specificità ma una minore sensibilità.
Significato clinico di valori normali e anormali
I valori di pH del sangue ombelicale alla nascita, non danno un’indicazione altamente sensibile e specifica di danno permanente. Esistono diverse ovvie ragioni per questo. Feti e neonati possono recuperare più o meno rapidamente da un episodio asfittico e tale episodio può, ma può anche non esitare in un danno organico permanente. Pertanto, la maggioranza dei bambini nati con pH del sangue ombelicale basso, godono di uno sviluppo psicomotorio normale (42). D’altra parte episodi asfittici non rilevati in utero o nella infanzia precoce, possono dare origine ad un danno permanente. Ciò spiega perchè molti bambini con danno cerebrale, erano nati con un pH normale del cordone ombelicale. Inoltre, un danno permanente può seguire ad una malattia genetica o infettiva senza alcun segno di disturbo dell’omeostasi fetale.
Se il pH ombelicale non è in grado di prevedere l’outcome a lungo termine, qual’è, quindi, il suo significato?
Un valore di pH di sangue del cordone ombelicale normale indica che il feto era in buone condizioni alla nascita. Se ciò corrisponde con l’evidenza del quadro clinico, l’ostetrico può concludere che il bambino non necessità di un’immediata assistenza specialistica. Il pH ombelicale dà anche elementi importanti nella valutazione dell’assistenza intraparto, sia nei casi con esito buono, sia nei casi con esito preoccupante. Il pH del sangue del cordone ombelicale normale alla nascita dimostra che la gestione del parto non ha daneggiato il feto. Puó anche retrospettivamente indicare che l’intervento ostetrico d’emergenza è stato o efficace o superfluo.
Un pH del sangue ombelicale normale alla nascita può escludere con una ragionevole certezza una carenza di ossigeno durante il travaglio. Ciò è vero anche per neonati nati con pH ombelicale normale ma clinicamente depressi. La causa per questi valori bassi di Apgar dovrebbe quindi essere ricercata in fattori quali: medicazione materna, trauma da parto, anomalie congenite, ecc.
Un valore anormale di pH ombelicale indica che il feto era in uno stato di scompenso biochimico al tempo della nascita. Se questo è associato ad un valore di
Apgar score basso è necessario che vengano iniziate procedure di rianimazione prima che il risultato del pH anormale sia disponibile. Una adeguata ventilazione generalmente è sufficiente per contrastare l’acidemia.
Tuttavia, una documentazione di un’asfissia perinatale indica che le cure neonatali devono avvenire in un centro di terapia intensiva, poiché, è aumentato il rischio di un’ encefalopatia ipossico-ischemica.
Se un bambino è nato con valori di pH del sangue ombelicale anormale ma con punteggio Apgar normale, la prognosi è più favorevole, ma è comunque necessario un esame completo, compresa l’osservazione, almeno finche il valore del pH del sangue è ritornato alla norma.
Valori di pH del sangue del cordone anormali dovrebbero aiutare gli ostetrici perinatologi a valutare criticamente la loro assistenza durante la gravidanza e il travaglio.
In fine, quando i genitori attendono la prognosi per il futuro sviluppo del loro bambino bisognerà informarli che questa non può essere data sulla base di un valore di pH del sangue ombelicale o del valore di Apgar. Sarà necessaria un’attenta osservazione del neonato durante i primi giorni di vita. Se si sviluppano segni di una encefalopatia moderata o severa (Sarnat grado 2 o grado 3), il rischio di morte o handycap permanente o notevole e un rapporto causale con l’asfissia perinatale, sarà più probabile (56).
L’assenza di tali segni è associata con una buona prognosi. Anomalie neurologiche residue come risultato di un’asfissia perinatale sono quindi improbabili.
Vantaggi della misura routinaria del pH del sangue su cordone ombelicale
Un pH del sangue dell’arteria ombelicale correttamente campionato, misurato, validato e interpretato fornisce l’indice più oggettivo e sensibile per l’asfissia durante il travaglio. E’ una misura non invasiva e anche poco costosa, ammesso che la sala parto sia equipaggiata come dovrebbe essere, con un’analizzatore di pH per campionare sangue fetale preso subito dopo il parto.
Il maggior vantaggio di una misurazione routinaria è che gli "addetti ai lavori" ottengono un immediato feedback sulla loro assistenza durante il parto e possono imparare da questa informazione.
Molti neonati con grave acidemia sono individuati precocemente, ciò porta ad una reazione più tempestiva e, in alcuni casi, alla prevenzione di complicazioni. In piú la misura routinaria offre nuove opportunità per l’audit. Una discussione regolare di casi con pH anormale del cordone ombelicale alla nascita aumenta la qualità delle politiche ospedaliere e le loro applicazioni.
Per quanto riguarda le richieste di indennizzo e proteste a posteriori, un pH ombelicale normale, praticamente esclude un’asfissia durante il travaglio.
In fine, la raccolta routinaria del pH del sangue del cordone dà una valutazione attendibile dell’outcome per studi retrospettivi.
Table V.
Completeness of reporting in departments with routine umbilical arterial blood pH measurement at birth.
Source: first author Number of deliveries Number of ombilical Completeness of reporting
(year of publication) examined arterial pH values of umbilical arterial pH
values in %
Romer (1976)30 4 081 3 804 93 %
Hiusjes (1979)39 1 547 852 55 %
Sykes (1982)31 1 210 899 74 %
Eskes (1983)40 5 499 4 667 85 %
Fee (1990)34 17 585 15 528 88 %
Perkins (1993)35 3 807 3 183 84 %
Goodlin (1994)36 12 507 11 203 90 %
Nagel (1995)42 2 536 1 614 64 %
Westgate (1995)11 1 448 2 013 72 %
Wetsgren (1995)38 4 710 3 953 84 %
These studies included only validated cord blood pH values
Svantaggi della determinazione routinaria del pH del sangue su cordone ombelicale
Circa il 98% dei valori di pH del sangue dell’arteria ombelicale, misurati, risulteranno normali o borderline, mentre circa il 90% dei neonati con risultati anormali non soffriranno di conseguenze permanenti.
In molti casi l’asfissia perinatale può essere accertata senza misurazione routinaria del pH. La misurazione routinaria risulta un costo ed un carico di lavoro ulteriori. Nonostante questo sforzo ulteriore, in almeno il 10% dei parti, il valore del pH del cordone ombelicale non viene documentato ( Tab.V) (11, 30, 31, 34-36, 38-40, 42).
Inoltre, se soltanto le misure validate vengono accettate, rimarranno non documentati circa il 25% dei valori di pH, o rimarranno dubbi se riflettono il pH arterioso o venoso (Tab.V).
La mancanza di cut-off di valori normali e anormali di pH, universalmente accettati, lasciano spazio ad interpretazioni controverse. In più, in caso di controversie medico-legali, una documentazione adeguata di un’ acidemia inaspettata alla nascita, può avere conseguenze negative per gli ostetrici che si sforzano di documentare e di valutare criticamente la loro pratica clinica.
Conclusioni
Misurazioni del pH del sangue ombelicale alla nascita, con metodi relativamente semplici e non invasivi , forniscono agli ostetrici e ai perinatologi, una misura oggettiva e sensibile sulla condizione del feto durante la fase finale del parto.
Nel momento in cui certi criteri vengono osservati, i valori riportati sono attendibili. Misurazioni routinarie possono essere di beneficio per gli ostetrici e i perinatologi che possono, così valutare criticamente la loro pratica clinica.
BIBLIOGRAFIA
Capitolo 7
Valutazione del benessere neonatale con determinazione routinaria del pH sul cordone ombelicale dopo il parto a Bolzano: 2 casistiche a confronto
7
.1 CASISTICHENella Divisione di Ginecologia e Ostetricia dell’Ospedale di Bolzano, è stata introdotta, a partire dal 1975, la determinazione del pH sul sangue dell’arteria ombelicale di tutti i neonati.
In questo capitolo sono riportati i risultati relativi al biennio 1987-1988, precedentemente pubblicati (1), e confrontati con la casistica degli ultimi parti dal 1998 fino al settembre 2002 (2).
In ogni gestante è stato eseguito il monitoraggio cardiotocografico continuo o intermittente del travaglio e del parto. Ogni neonato è stato inoltre valutato anche mediante il punteggio di Apgar a uno e a cinque minuti.
Dal 1987 al 1988 sono stati effettuati 2731 prelievi dell’arteria ombelicale del funicolo di altrettanti neonati. Dal 1998 al 2002 sono stati eseguiti 8299 prelievi.
Lo scopo di tale confronto è quello di determinare il valore di pH nelle varie modalità di parto (parto spontaneo, parto con taglio cesareo, parto con ventosa) per evidenziare differenze relative ad eventuali mutamenti, nel tempo, del management del parto.
Infine abbiamo esaminato, anno per anno, la variabilità degli indici di acidosi espressi dalla prevalenza, in percentuale, dei valori di pH inferiori, rispettivamente, a 7.2, 7.1 e 7.0.
Un altro scopo della nostra analisi è valutare il rapporto fra depressione neonatale (generalmente espressa con l’indice di Apgar) e l'asfissia.
I valori medi di pH di tutti i parti negli anni 1987/1988 erano 7.27 (prima deviazione standard 0,08) con 7.11 come seconda deviazione standard inferiore (-2DS) (Tab.1).
Negli anni 1998-2002 il valore medio del pH della arteria ombelicale di tutti i parti era 7.24, con una deviazione standard di 0,08 corrispondente a 7.08 come doppia deviazione standard inferiore (Tab.2).
Dalle tabelle si osserva, inoltre, un cambiamento della modalità del parto negli anni studiati. Pur restando invariato il numero dei parti spontanei (76, 7 % nel 1987/88 e 76,1 % negli anni 1998-2002), sono drasticamente diminuiti i parti con ventosa: da 7,9% nel 1987/88 a 2,8 % negli anni 1998-2002). La quota dei tagli cesarei è aumentata da 15,4% nel 1987/88 al 20,9 % negli anni 1998-2002.
Abbiamo riscontrato, dai dati confrontati, un sensibile aumento dell’indice di acidosi (pH<7.2) per i parti spontanei, passando dal 13,5 nel 1987/88 al 31,1% negli anni 1998/2002. Non vi è stata invece una sostanziale variazione dell’ indice di acidosi per i tagli cesarei (5,5% e 7.0%) e per i parti con ventosa (47,2% e 54,5%).
Abbiamo analizzato la correlazione fra indici di Apgar basso (inferiore a 4 al primo minuto) e tassi di acidosi (pH<7.1). In 290 neonati sul totale di 8299 abbiamo riscontrato un punteggio di Apgar inferiore a 4. Solo nell’ 11,7% dei casi di neonati depressi (Apgar inferiore a 4) si misurano valori di pH inferiore a 7.1.
Nei neonati con acidosi (pH<7.1) il 33% ha Apgar a un minuto inferiore a 7, mentre il 67% ha Apgar uguale o superiore a 7.
Nelle acidosi gravi (pH<7.0) i neonati (11 casi su 8299), con Apgar inferiore a 7, erano il 24% mentre il 76 % dei feti con pH<7.0 (34 casi su 8299) avevano un indice di Apgar uguale o superiore a 7.
Tabella 1: Casistica degli anni 1987-1988 con numero dei casi e percentuale, pH medio, percentuali per pH inferiore a 7,20 e pH inferiore a 7,10 secondo le diverse modalità del parto.
|
N. |
% |
pH med. |
pH<7.2 |
pH<7.1 |
|
|
TUTTI I NEONATI |
2731 |
100 |
7,26 |
14,6% |
2,0% |
|
MOD. DEL PARTO: |
|||||
|
PARTO SPONT. |
2094 |
76,7 |
7,27 |
13,5% |
1,6% |
|
VENTOSA OSTET. |
218 |
7,9 |
7,19 |
47,2% |
10,0% |
|
TAGLIO CESAREO |
419 |
15,4 |
7,28 |
5,5% |
2,1% |
Tabella 2: Casistica degli ultimi parti dal 1998 con numero di casi e percentuale, percentuali per pH inferiore a 7,20, pH inferiore a 7,10, pH medio e seconda deviazione standard per modalità del parto.
|
N. |
% |
pH<7.2% |
pH<7.1% |
pH medio |
-2DS |
|
|
MOD. DEL PARTO: |
||||||
|
PARTO SPONT. |
6315 |
76.1 |
31.1 |
2.8 |
7.23 |
7.09 |
|
VENTOSA OSTET. |
235 |
2.8 |
54.5 |
12.3 |
7.18 |
7.02 |
|
TAGLI CESAREI |
1733 |
20.9 |
7.1 |
2.3 |
7.3 |
7.15 |
7.1 TECNICA DI PRELIEVO E MISURAZIONE
Il prelievo per la misurazione del pH sul sangue del cordone ombelicale, viene eseguito subito dopo la nascita e prima del secondamento, su un tratto di cordone doppiamente clampato e resecato (Figura 1).
Mediante un’ago di diametro 21 G., connesso ad un capillare eparinato (Figura 1), viene prelevata una quantià sufficiente di sangue (ca. 50 mcl) dall’arteria ombelicale, facendo attenzione, affinché, il campione risulti privo di bolle d’aria, anche se, una minima quantità di aria (20% del volume del sangue contenuto in siringa) può non compromettere significativamente il campione (Figura 2).
Dopo aver chiuso, con appositi tappi di gomma le estremità del capillare, si procede alla "eparinizzazione" del sangue, evitando la formazione di coaguli, mediante una calamita che fa muovere una barretta di metallo introdotta nel capillare stesso dopo il prelievo (Figura 3).
Si utilizzano anche siringe eparinizzate preconfezionate, contenenti all’interno una quantità costante di eparina, in modo tale da minimizzare gli errori legati all’eccesso o al difetto delle concentrazioni della sostanza che può interferire con l’equilibrio acido-base ematico simulando un’acidosi metabolica (Figura 4).
I costi delle siringhe preconfezionate sono maggiori.
Se risulta difficoltoso il prelievo dall’arteria ombelicale lo si esegue sulle arterie del piatto coriale, le quali si individuano facilmente essendo a cavallo degli altri vasi (Figura 5).
Quanto prima, si procede alla esecuzione della emogasanalisi che viene effettuata mediante un emogasanalizzatore.
Dal 1975 fino agli anni ’90, le misurazioni sono state eseguite con un emogasanalizzatore: ABL 330 (RADIOMETER – COPENHAGEN),
da allora l’emogasanalisi viene eseguita da un IRMA SL 2000 (EUROMED Srl - Padova). Post porre il prelievo anche di un’ora, pur tenendo il cordone a temperatura ambiente, non modifica significativamente il pH e gli altri parametri (3,4,5,6).
Tutte le misurazioni sono effettuate subito dopo la raccolta del campione e comunque entro 15 min. dal parto (normalmente durante il periodo del secondamento) dal personale medico o dalla ostetrica che ha assistito al parto.
Figura 1.
Tratto di cordone ombelicale doppiamente clampato e resecato, siringa eparinata pronta e ago di diametro 21 G. connesso al capillare eparinato
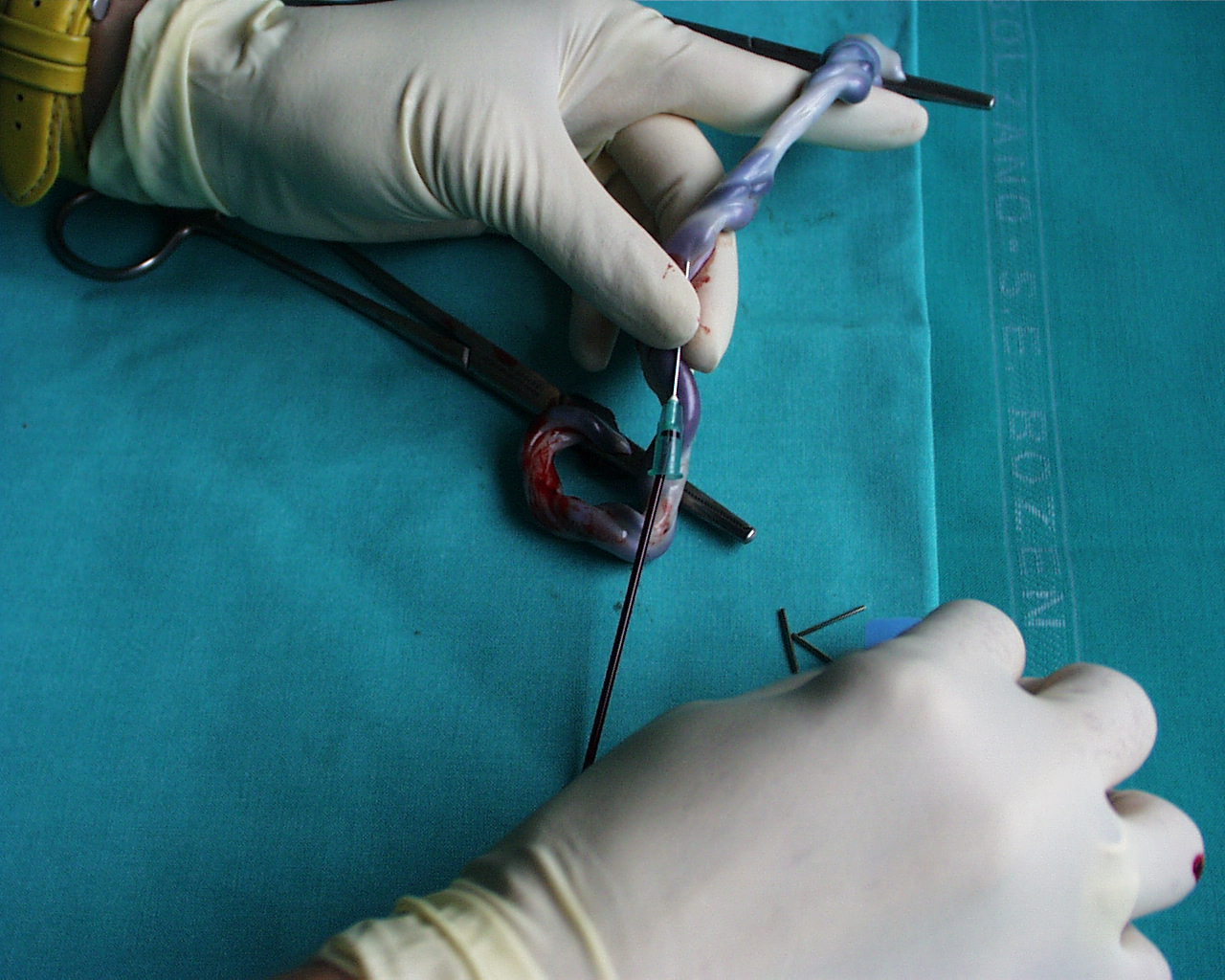
Figura 2
. Prelievo di sangue dall’arteria ombelicale mediante ago di diametro 21 G. connesso al capillare eparinato
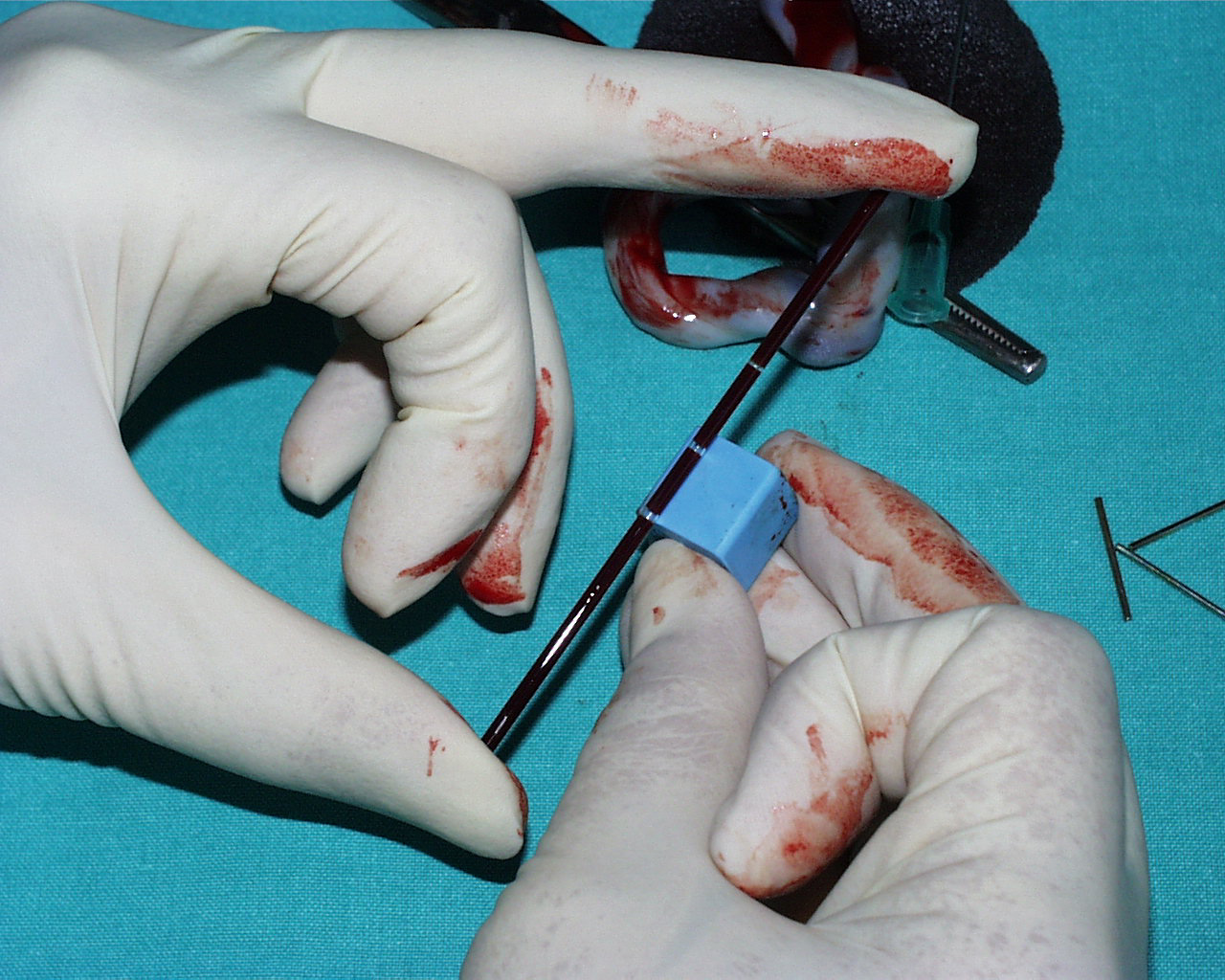
Figura 3.
"Eparinizzazione" del sangue, mediante calamita introdotta nel capillare dopo il prelievo.
Figura 4.
Prelievo di sangue dall’arteria ombelicale mediante siringa eparinizzata preconfezionata
Figura 5.
Prelievo sulle arterie del piatto coriale
Commento
L’aumento sensibile dell’ indice di acidosi limitato ai parti spontanei induce ad una importante riflessione sulle modalità di conduzione del parto. Negli ultimi anni è invalsa una gestione "di attesa" nel periodo espulsivo che verosimilmente conduce ad un aumento delle acidosi respiratorie che chiaramente correlano con la durata del periodo espulsivo . Un generale ma non sostanziale aumento degli indici di acidosi fa anche pensare ad una differente taratura della macchina come possibile causa essendo rimasta uguale la metodica del prelievo.
L’aumento del numero dei tagli cesarei ed il ricorso più raro al parto operativo vaginale si spiega forse anche con una selezione più accurata delle gestanti a rischio per i problemi espulsivi del parto. I nostri dati non sembrano essere in linea con l’ aumento indiscriminato dei tagli cesarei a cui si assiste nel resto d’Italia.
Abbiamo potuto osservare nella nostra casistica recente, come risulta dai dati della letteratura, che nei neonati con indice di Apgar a un minuto patologico (<4), solo in un esiguo numero di casi (11,7%), si rileva acidosi eventualmente dovuta ad asfissia. Questo importante dato permette di escludere la asfissia da parto in ben 9 su 10 casi di neonati depressi.
Nei neonati con acidosi (pH<7.1) la quota di neonati con Apgar patologico (<7) è di circa un terzo.
Solo un terzo dei feti con acidosi grave (pH<7.0) ha un Apgar inferiore a 7.
Correlazione tra Apgar e pH: revisione della letteratura
Il punteggio di Apgar e il pH sull’arteria ombelicale alla nascita sono due criteri che non valutano lo stesso aspetto delle condizioni del feto, piuttosto sono metodiche complementari per valutare lo stato immediato del neonato.
I numerosi studi che hanno messo a confronto il pH dell’arteria ombelicale e l’indice di Apgar non hanno mostrato una ipotizzabile correlazione.
Sykes (7) in uno studio prospettico su 1210 nati consecutivamente, ha dimostrato che soltanto nel 21% dei neonati, con indice di Apgar ad 1 minuto < 7 , e nel 19 % con punteggio a 5 minuti < 7, era presente una acidosi severa (pH dell’arteria ombelicale < 7.10), mentre il 73 % dei neonati con acidosi severa avevano un indice di Apgar a 1 minuto > 7 e l’86 % uno score a 5 minuti > 7.
La mancata correlazione fu anche dimostrata dagli studi di Silverman (8) il quale concluse che le alterazioni biochimiche dovevano essere molto gravi affinchè si manifestasse un’associazione significativa con un basso Apgar score.
La discrepanza tra Apgar score ed acidosi può essere dovuta all’influenza, sui parametri dello score, del livello delle catecolamine indotto dall’evento asfittico, motivo per cui, neonati con lo stesso grado di acidosi potrebbero mostrare un Apgar score normale o basso, in relazione al maggiore o minore livello di catecolamine circolanti.
La mancata correlazione è evidente anche nel neonato pretermine: quanto più è prematuro il neonato, tanto più è probabile che l’indice di Apgar sia basso, nonostante un valore di pH dell’arteria ombelicale ≥ 7.25, mentre viceversa, quanto più un neonato è vicino al termine, tanto più ha frequentemente un Apgar ≥ 7 con un pH dell’arteria ombelicale < 7.25 (9).
Tutto questo è dovuto al diverso significato dei parametri presi in considerazione: il pH dell’arteria ombelicale è indice della funzione placentare, mentre l’indice di Apgar è espressione del grado di adattamento del neonato alla vita extrauterina, ovviamente inferiore nel neonato pretermine (10,11).
Il punteggio di Apgar
è basso, il pH sull’arteria ombelicale è normale.Si tratta dei casi classificabili come falsi negativi.
Si possono riscontrare:
Il punteggio di Apgar è normale, il pH sull’arteria ombelicale è basso.
Può succedere:
- nei casi di asfissia di breve durata o di asfissia cronica con perfetto compenso da
parte del feto; nella fase iniziale dell’ipossia, con un aumento della sola pCO2 , il
bambino probabilmente non è depresso, inoltre, un intervento adeguato ha potuto
evitare l’aggravamento dell’ipossia; un Apgar normale con pH basso può significare allora che sono state adottate le misure adeguate (12);
In conclusione: il pH sull’arteria e la vena ombelicale sono espressione dell’equilibrio acido-base del feto alla nascita; il punteggio di Apgar è un indice clinico per l’assistenza in sala travaglio. Se l’Apgar è basso e il pH normale no vi è stata asfissia in utero; se l’Apgar è normale o basso e il pH è basso, si è verificato un episodio di asfissia in utero.
Il pH è una foto istantanea dell’equilibrio acido-base. L’associazione Apgar basso-pH normale è un’istantanea che può variare, evolvendo sia verso un Apgar normale con pH normale (adeguato trattamento immediato), sia verso un Apgar basso con acidosi (trattamento immediato non del tutto adeguato).
BIBLIOGRAFIA
Capitolo 8
Riflessioni sugli aspetti
medico-legali
"
Più l’intervento è semplice, più il medico chirurgo che sbaglia faticherà in tribunale, dato che, spetta al medico giustificarsi e non al paziente dimostrarne la colpa."Questo è in sintesi il principio cardine che è stato ribadito dalla terza sezione civile della Cassazione in una lunga ed articolata sentenza: la n. 11316/03.
Con questa sentenza la suprema corte ha tracciato la via che spetta ora ai medici percorrere; in altre parole gli stessi medici devono munirsi di metodiche oggettive, sotto il profilo medico-legale, al fine di relazionare una consulenza tecnica che sia in grado di rispondere all’incertezza ed al dubbio circa l’esistenza di una eventuale responsabilità del medico-chirurgo.
Alla luce di quanto detto, l’esame del pH diventa uno strumento formidabile e definitivo che esclude l’asfissia da parto come causa del danno cerebrale nel neonato e in molti casi, l’esame in questione, ha evidenziato come, tale danno, è stato di origine antepartale.
A questo punto la posizione del ginecologo, che ha assistito al parto, è, come facile intuire, del tutto estranea all’evento lesivo che dipende da altre condizioni non causate dalla gestione del parto.
Abbiamo riferito dell’esattezza e della precisione dell’esame in questione.
A livello giudiziario un’eventuale perizia con queste metodologie lascerebbe poco spazio alle strategie difensive o accusatorie delle parti processuali o al libero convincimento del giudice basato sulla C.T.U.
Mariarosaria Di Tommaso, ginecologa e medico legale a Firenze, sostiene che le resistenze all’utilizzo del pH, per la verifica oggettiva e non soggettiva delle condizioni alla nascita, sono diventate sempre più deboli e la metodica viene impiegata sempre più frequentemente, a Firenze viene impiegata in modo abbastanza estensivo seppure in modo non sistematico. Personalmente la Di Tommaso, utilizza il pH ematico sul cordone, in tutti i casi di taglio cesareo di urgenza, nei parti operativi, in tutte le circostanze in cui ci sono CTG dubbi o francamente patologici, seppure per periodi brevi, e in tutti i casi dove vi è il sospetto di fattori di rischio per danno cerebrale di origine antepartale (infezioni aspecifiche, infiammazioni, ritardi di crescita ,anomalie genetiche, etc).
A Suo avviso l’argomento più convincente per superare le resistenze di quanti impropriamente ritengono che in tal modo si "autodocumenti" una asfissia ( atto che potrebbe ritorcersi contro sotto il profilo medico-legale), è rappresentato:
In altre parole mancando il pH, si ricorre alla CTG ( o peggio, ancora alla sua mancanza) per desumere le condizioni subito prima della nascita, e la CTG si offre, molto di più del pH, ad etichettare impropriamente una sofferenza fetale che non c’è, oppure se c’è, non è da relazionare al travaglio ma, per esempio, all’epoca antepartale. Quindi, in tutti quei casi di danno cerebrale che arrivano nei tribunali, dove c’è la tendenza ad addossare al ginecologo, che ha assistito al parto, la responsabilità di eventi che con il parto non hanno nulla a che fare, il valore del pH alla nascita ridimensionerebbe la posizione dell’eventuale indagato la cui colpa sarebbe alleggerita se non stralciata.